根据2023年3月6日发布的《药品共线生产质量风险管理指南》,持有人和药品生产企业在评估多产品共线生产的可行性时,需要形成共线生产风险评估报告。
该《指南》在说明药品共线生产质量风险时,多次提到HBEL评价。除此之外,还有不少国际机构及组织在有关药品共线生产和清洁验证的指南及指导原则中提及HBEL。
那么,究竟什么是HBEL?为什么HBEL与药品共线生产如此关系紧密?是否所有的药品都需要HBEL评价?具体又该如何进行HBEL计算呢?
国际机构及组织的指南及指导原则包括:
组织 | 法规名称 | 关键点 |
CFDI 2023 | 药品共线生产质量风险管理指南(公布稿) | 活性物质残留限度标准应当基于产品毒理试验数据或毒理学文献资料结合实际生产情况建立,并在产品生命周期内进行定期评估。相对于传统方法设定的限度来说,基于健康的暴露限度(HBEL)的可接受标准在评估清洁残留数据时更具有科学性和优势。 |
APIC 2021 | 《Guidance on Aspects of Cleaning Validation in Active Pharmaceutical Ingredient Plants》 | 在可以获得足够数据时,应采用基于健康的暴露限度(HBEL)(可以是ADE或PDE值)计算最大允许残留 |
WHO 2021 | 《Annex 2: Points to consider when including Health-Based Exposure Limits (HBELs) in cleaning validation》 | 需要得到以HBEL为基础的残留限度,传统的限度设置方式可能不再是可接受的,同时相关的HBEL数值、PDE报告、清洁验证和计算的结果与数据都需要完整保存。 |
EMA 2015 | 《EMA/CHMP/CVMP/SWP/169430/2012, Guideline on setting health based exposure limits for use in risk identification in the manufacture of different medicinal products in shared facilities》 | 所有药品都需要得到HBEL,而且不能使用LD50作为作用起始点PoD |
首先,我们来回答最令大家关心的一个问题:是否所有的药品都要HBEL评价?
答案:是的。所有药品都需要建立HBEL。
用于计算HBEL的毒理或药理数据需要在药品生命周期中定期评估。
2018年欧洲药品管理局(EMA)发布《交叉污染和共用设施清洁限度指南问答》中的第一个问答就解答了无数制药人心心念念的问题。

(图片源自:欧洲药品管理局 EMA)
鉴于所有药品都需要建立HBEL,在此我们为大家详细介绍HBEL评价及其应用,以及HBEL相关计算方法,以供参考。
HBEL的定义
HBEL,即基于健康的暴露限度。
HBEL应该计算为每日可接受暴露量(ADE)或每日允许暴露量(PDE)。这些值之间能够有效比较,并且代表着对任何给药途径下终生摄入低于等于该剂量时不可能导致不良反应的日暴露值的估测。
HBEL:Health Based Exposure Limits
ADE:Acceptable Daily Exposure
PDE:Permitted Daily Exposure
HBEL的应用
◆ 清洁验证

设备清洁验证考虑清洁可接受限度时,活性物质残留限度标准应当基于产品毒理试验数据或毒理学文献资料结合实际生产情况建立,并在产品生命周期内进行定期评估。
评估过程应遵循HBEL、毒理学研究数据等的制定策略,并记录评估过程,包含但不限于物质毒理危害的识别、阈剂量的获取、PDE计算过程校正因子的选择、用于识别危害的参考文献或原始试验数据等。
传统方法 | HBEL |
1/1000最低日治疗剂量、10 ppm方法等 | PDE、ADE等 |
一刀切,存在风险,对于某些抗生素类、细胞毒类抗肿瘤药物或高活性产品,传统限度值可能会超过PDE值,如果采用传统方法设定的限值,对患者长期暴露可能起不到充分保护 | 更具有科学性和优势 |
◆ 产品风险评估
在使用PDE或ADE值时,按照以下危害递增原则(红色为最高危险)建立标准并对产品进行评估:

(图片源自:《药品共线生产质量风险管理指南》)
一旦完成基于健康的评估并确认HBEL,应通过质量风险管理流程使用这些数据,以确定需要实施哪些控制措施,并评估现有的组织和技术控制措施是否足够或者是否需要补充。
预计对于对患者/动物具有较高潜在危害的产品,将需要更详尽的组织和技术控制措施。
如果控制措施不能充分确保潜在污染一直控制在低于HBEL的水平,那么相关产品应在专用设施中生产。
◆ 杂质限度控制
例如,对于有实际阈值证据的致突变杂质的监管,在可获得相关数据的前提下,可通过计算PDE来确定可接受暴露量,从而制定可行的限度。
HBEL的计算方法
HBEL可由ADE和PDE计算。
需要注意的是,LD50不能用于HBEL的评价,因为LD50值在预测长期效应方面并不可靠。
EMA发布的《交叉污染和共用设施清洁限度指南问答》和PIC/S PI 053-1都有提到这一要求。

(图片源自:欧洲药品管理局 EMA)
◆ PDE的计算
PDE指药物或产品每日可接受的最大摄入量,由大多数相关动物研究中的未观察到作用水平(No Observed Effect Level, NOEL)或观察到作用的最低水平(Lowest Observed Effect Level, LOEL)得出。
可采用如下计算方法和评估方法:
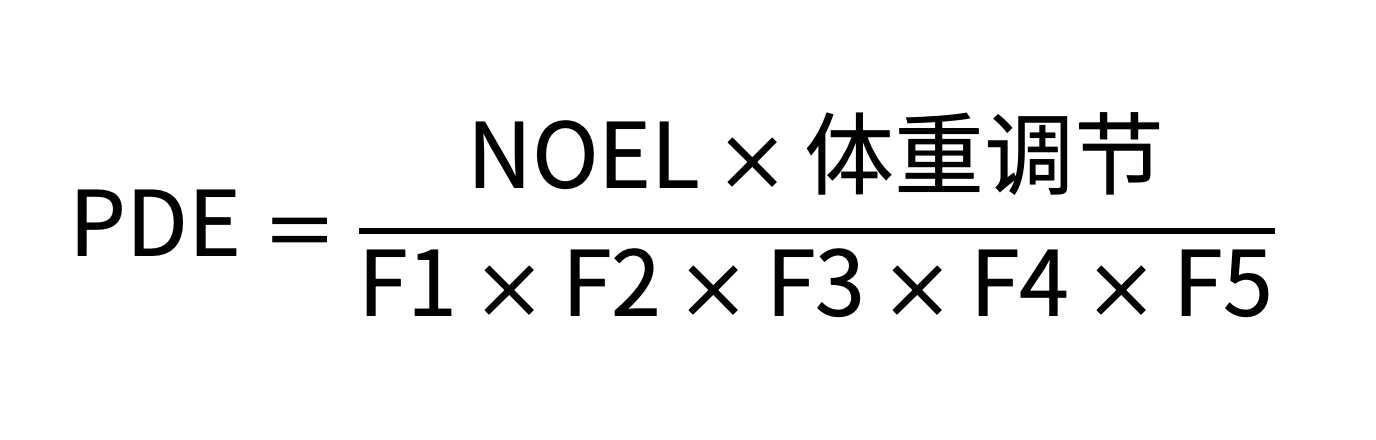 PDE首选用NOEL得出计算。如果没有NOEL值,可用LOEL。采用校正因子将数据与人体关联,各校正因子如下:
PDE首选用NOEL得出计算。如果没有NOEL值,可用LOEL。采用校正因子将数据与人体关联,各校正因子如下:
F1 = 考虑物种间差异的因子
F2 = 考虑个体差异的因子
F3 = 考虑短期暴露的毒性研究的可变因子
F4 = 在严重毒性的情况下可应用的因子。
F5 = 未确定无反应水平时可应用的可变因子
体重调整假设任何成年人的体重为50 kg(不论性别)。相对于这类计算中常用的60 kg或70 kg标准体重,较小的体重提供了额外的安全因子。有些成年患者体重小于50 kg。在确定PDE时,对这些患者应考虑对固有的安全因子进行调整。
以上公式仅为PDE的计算方式之一,还可以使用以下计算公式如:
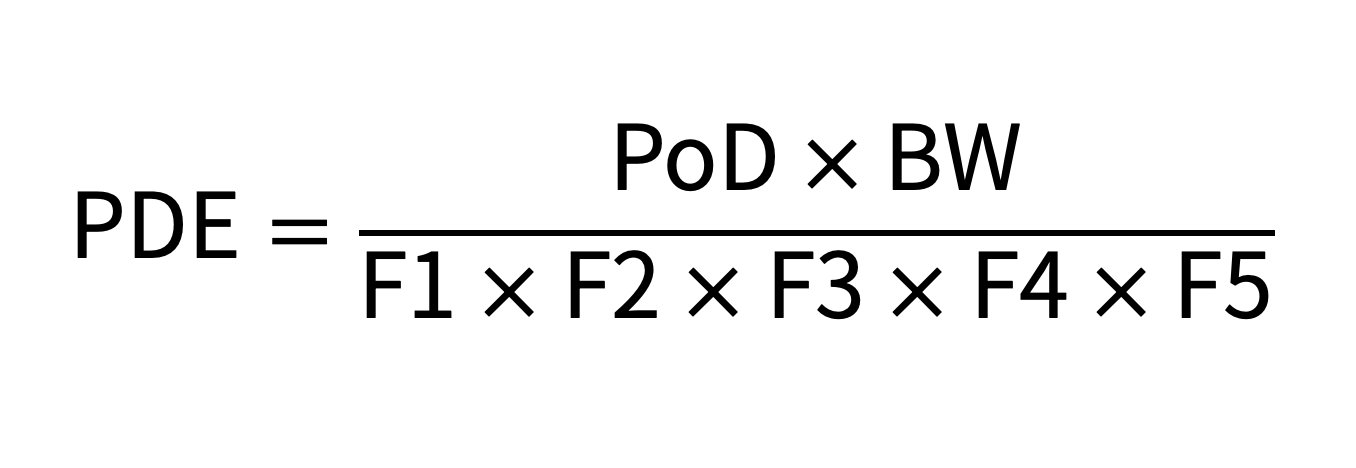 ◆ ADE的计算
◆ ADE的计算
ADE是在对健康不产生副作用的前提下,患者在终生时长内每天可以暴露于该物质的浓度限度,可以使用以下计算公式:
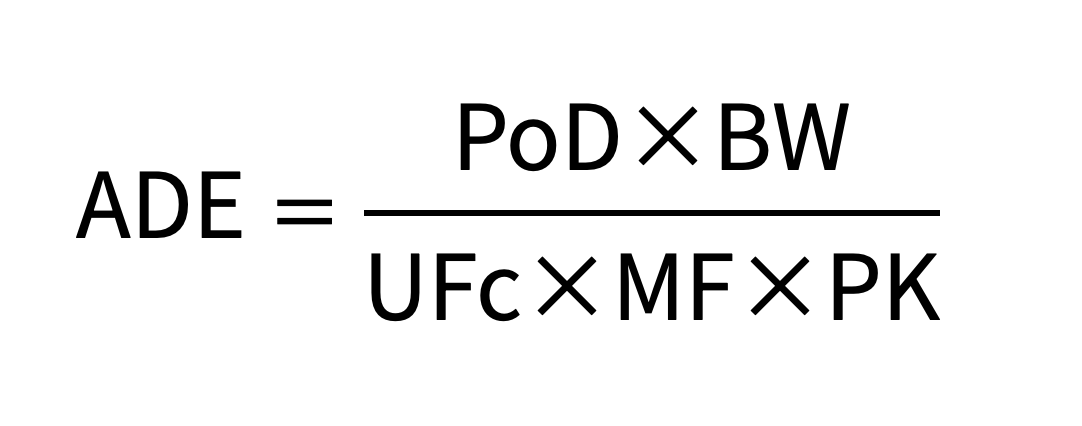
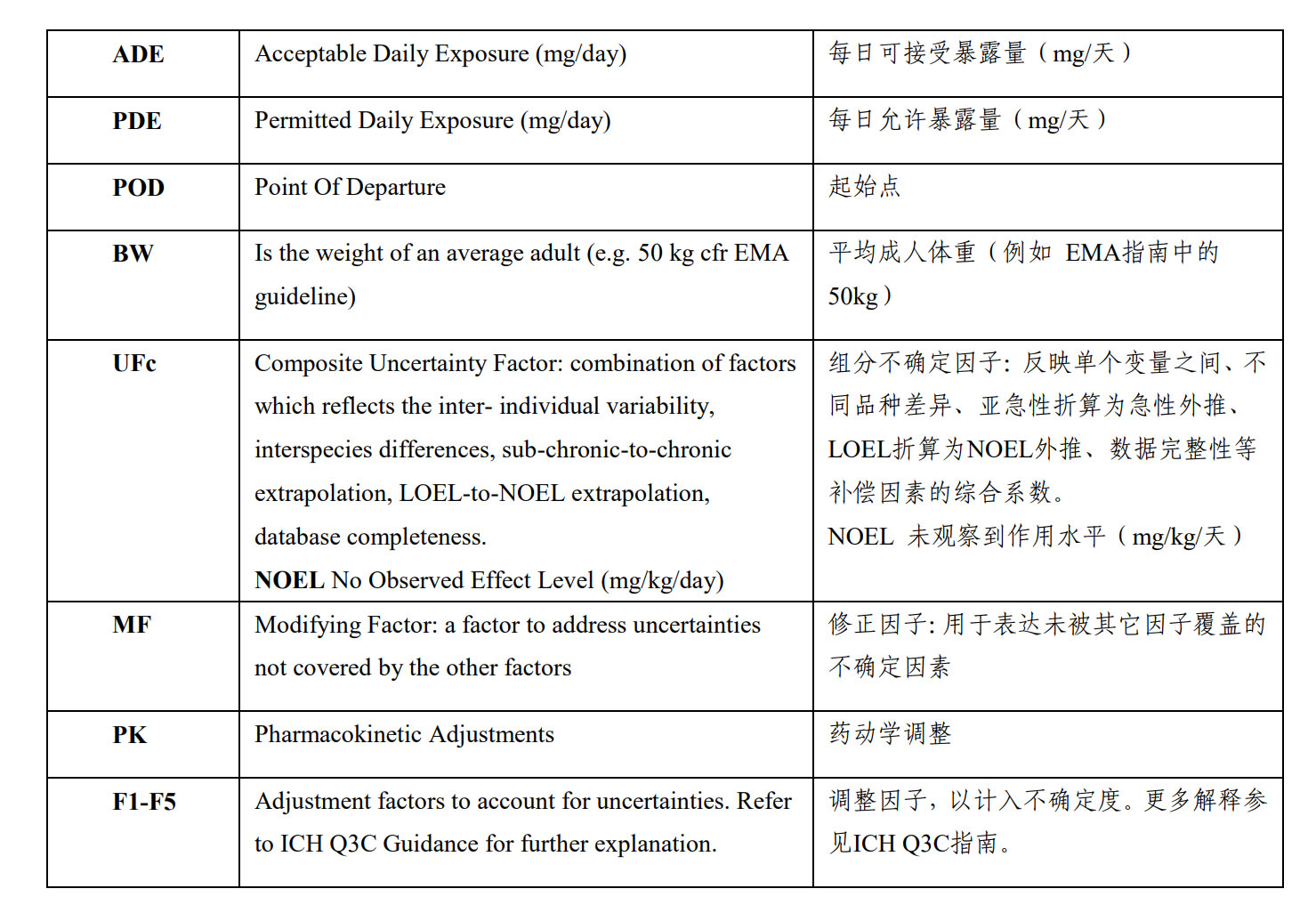
(图片源自:《药品共线生产质量风险管理指南》)
◆ 资料查阅
PDE/ADE的计算常用NOEL或LOEL等,可通过资料查阅该物质的的参考文献或原始试验数据等获得。
在此介绍几个数据库:
(1)PubMed:https://pubmed.ncbi.nlm.nih.gov/
(2)PubChem:https://pubchem.ncbi.nlm.nih.gov/
(3)CPDB(致癌性数据库):https://www.toxinfo.io/
(4)FDA(美国食品药品监督管理局):https://www.accessdata.fda.gov/scripts/cder/daf/index.cfm
(5)EMA(欧洲药品管理局):https://www.ema.europa.eu/en/medicines
…
◆ HBEL推导流程
评估HBEL时需审查该物质所有相关药理毒理等数据进行危害识别,识别“临界效应”,确定被认为是临界效应的PoD,并使用多个校正因子来考虑各种不确定性,最后用PoD计算PDE。
✅ 尽管HBEL评价相较于传统方法更具有科学性和优势,但HBEL评价对评估人员的专业性也提出了更高的要求,起草HBEL报告的人应在毒理学/药理学方面具备足够的专业知识和经验,在药品相关领域及PDE评估方面具有丰富的经验,并且具有资质证书的毒理学家。
相关阅读:
基于健康的暴露限度HBEL计算服务(ADE/PDE/OEL)
《药品共线生产质量风险管理指南》正式发布,残留限度制定将需参考PDE数值!
▼▼
关注“瑞欧科技”
获取HBEL评价合规新资讯








 化学品合规
化学品合规
 化妆品合规
化妆品合规
 检验检测
检验检测
 安全管理智能化
安全管理智能化
 绿色低碳可持续
绿色低碳可持续
 药品合规
药品合规
 食品合规
食品合规
 食品接触材料/再生塑料
食品接触材料/再生塑料
 中国农药登记
中国农药登记
 境外农药登记
境外农药登记