在制药生产过程中,确保产品质量与操作人员的安全至关重要。近年来,随着科学的发展和监管要求的提升,基于健康的暴露限度(HBEL)、职业暴露限值(OEL)、职业暴露等级(OEB)等概念逐渐受到重视。
瑞欧佰药将通过本文详细介绍HBEL、OEL、OEB的定义、计算方法、应用场景及三者之间的异同,旨在帮助制药行业同仁更好地理解和应用这些关键概念。
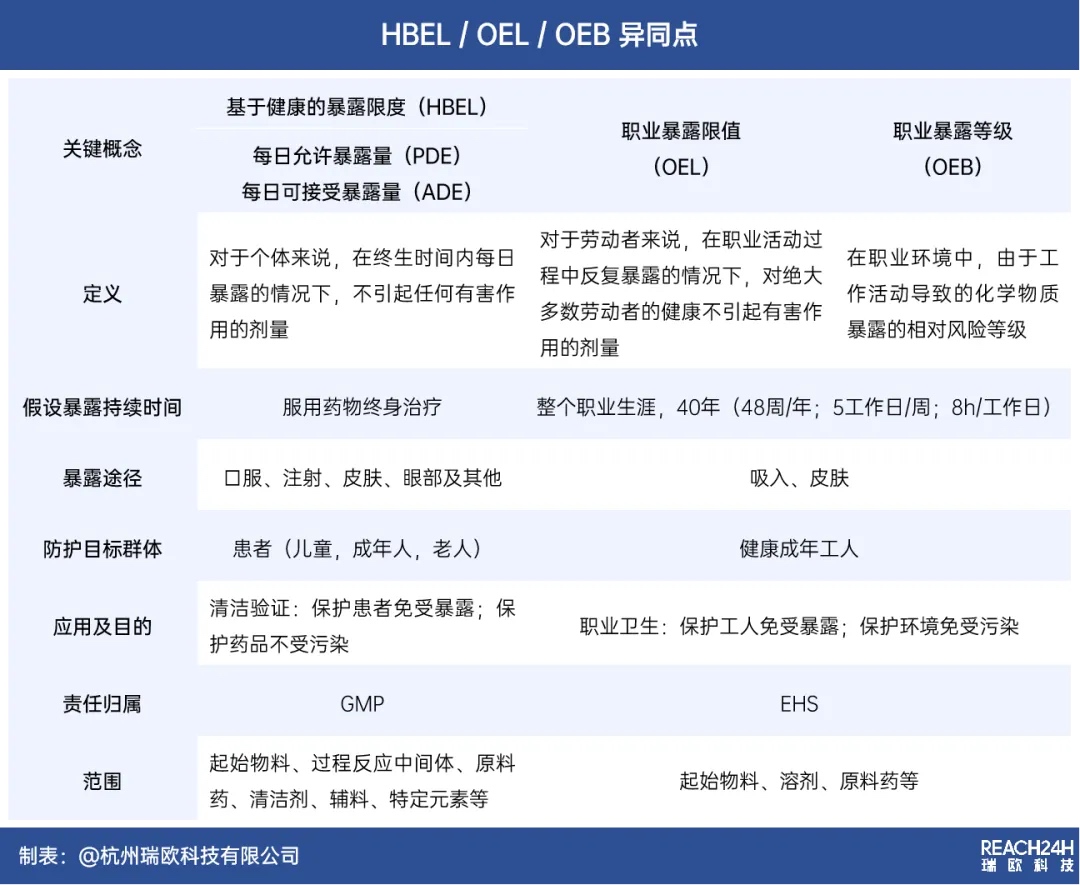
HBEL:基于健康的暴露限度
HBEL(Health Based Exposure Limits,基于健康的暴露限度)是用于表征物质危害程度的数值,表示在一定限度内的污染被认为是安全的。2015年,欧洲药品管理局(EMA)发布的指南中首次明确提出 HBEL 的概念。
这一概念的提出,颠覆了以往依赖千分之一最低日剂量或10ppm来评估清洁残留数据的传统方法,为药品研发、清洁验证以及共线生产评估带来了更为科学和先进的手段。
自EMA首次提出HBEL概念以来,全球多个国际机构及组织,如EMA、ISPE、WHO、CFDI等相继发布了相关指南和问答,对HBEL的计算、应用及评估人员资质等提出了明确要求。
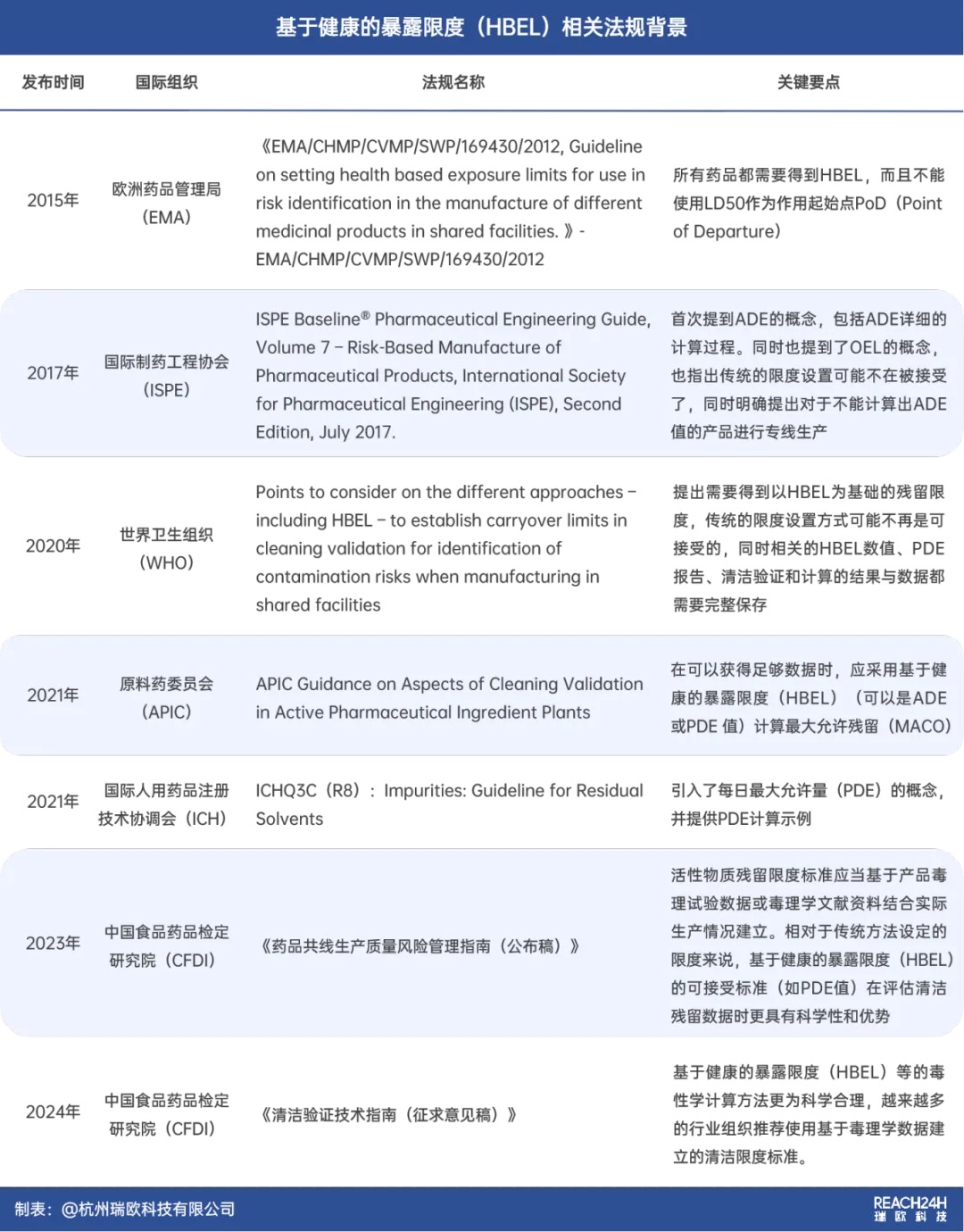
综合审视上述法规,制药行业已明显从传统模式转向以风险和科学为基础的控制理念,并且从依赖传统方法转变为遵循HBEL的控制要求。
确立物质的HBEL值已成为各监管机构的普遍趋势,同时要求用于HBEL计算的毒理学或药理学数据必须在产品全生命周期内定期复审评估。
计算评估
根据APIC发布的《原料药工厂清洁验证指南》,针对HBEL的确定提出了两种方法。
对于有相关毒性数据的物质,可以通过计算PDE(Permitted Daily Exposure,每日允许暴露量)或ADE(Acceptable Daily Exposure,每日可接受暴露量)来确定;对于缺乏毒性数据的物质,则可以根据化合物的结构进行毒性评估。
▌PDE
➥ 计算公式:PDE优先选用NOEL(No Observed Effect Level,未观察到作用水平)得出计算,如果没有NOEL值,可用LOEL(Lowest Observed Effect Level,观察到作用的最低水平)值,计算公式及评估方法如下所示:
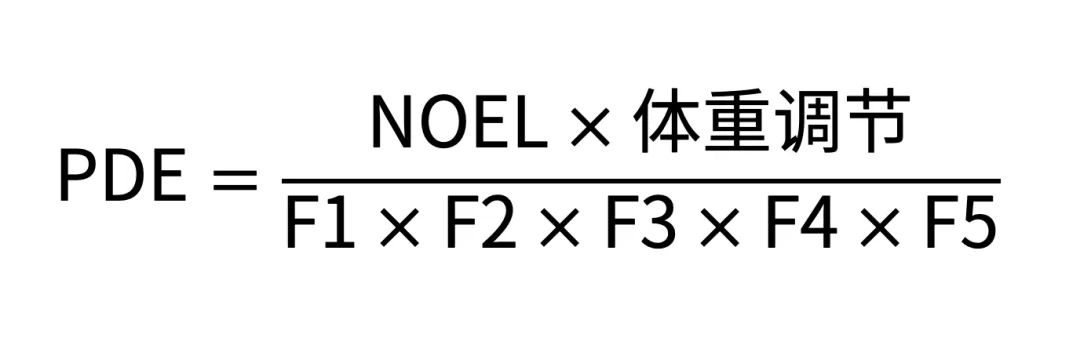
➥ 数据来源:PDE的计算常用NOEL或LOEL等数据,可通过资料查阅该物质的参考文献或原始试验数据等获得:
数据库
PubMed:https://pubmed.ncbi.nlm.nih.gov/
PubChem:https://pubchem.ncbi.nlm.nih.gov/
Toxline:https://www.libraries.rutgers.edu/databases/toxline
CPDB:https://www.enhesa.com/sustainablechemistry/our-solutions/toxplanet/
官方网站
IARC:https://www.iarc.who.int/
AEMPS:https://www.aemps.gob.es/
EMA:https://www.ema.europa.eu/en
FDA:https://www.fda.gov/
ECHA:https://www.echa.europa.eu/
▌ADE
ADE是在对健康不产生副作用的前提下,患者在终生时长内每天可以暴露于该物质的浓度限度,即每日可接受暴露量(Acceptable Daily Exposure),可以使用以下计算公式得出:
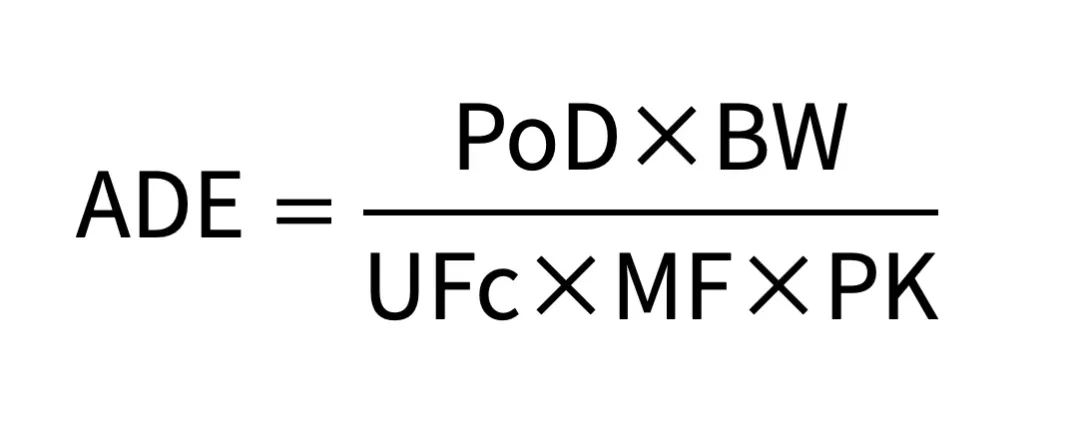
推荐阅读 | HBEL计算详解:基于健康的暴露限度(HBEL)评价及计算方法详解,全面掌握HBEL评价流程及应用
▌无数据评估
对于缺乏毒性数据的化合物,HBEL 评估可通过化合物的具体结构、TTC分类、交叉参照法及QSAR预测等方法进行。
➥ TTC分类:依据多兰原则,化合物可被分为以下三类进行HBEL值的估算:
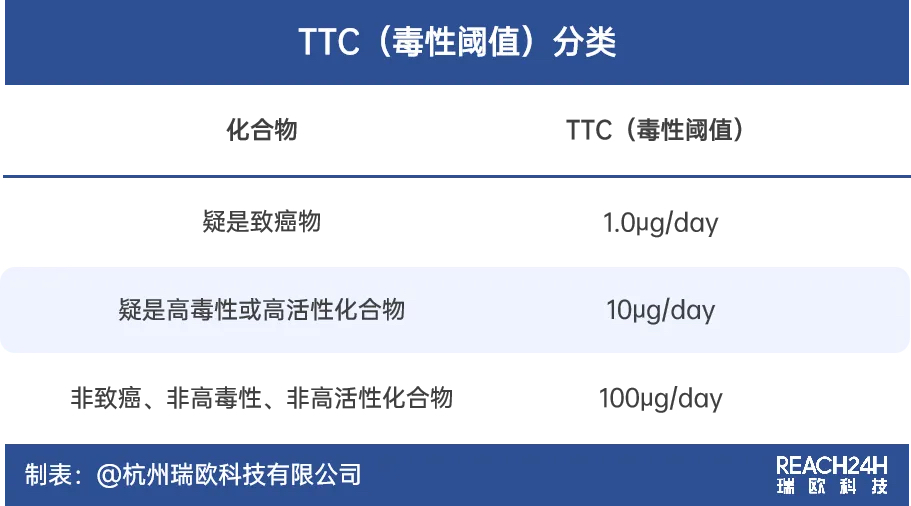
只要确保杂质的摄入量低于TTC分类结果得出的阈值,就可以认为在人类生命周期内,该杂质的存在不会对人体造成危害。
➥ 交叉参照法(Read-Across):通过分析结构相似的已开发化合物的毒理学数据,推测目标化合物的毒性行为。
➥ QSAR预测:利用定量构效关系(QSAR)软件,基于化合物的结构预测其毒性数据节点,并参与HBEL的计算。
值得注意的是,虽然上述方法具有一定的优势,但在应用时需谨慎,原因如下:
结构相似性不代表毒性相似:某些结构相似的化合物可能在体内的吸收、分布、代谢和排泄(ADME)过程中表现出显著差异,导致毒性效应不同。
作用机制的重要性:在评估化合物的潜在安全性风险时,作用机制的研究至关重要。仅依赖结构相似性进行毒性预测可能存在偏差。
应用场景
▌清洁验证
设备清洁验证考虑清洁可接受限度时,活性物质残留限度标准应当基于产品毒理试验数据或毒理学文献资料结合实际生产情况建立,并在产品生命周期内进行定期评估。

评估过程应遵循HBEL、毒理学研究数据等的制定策略,并记录评估过程,包含但不限于物质毒理危害的识别、阈剂量的获取、PDE计算过程校正因子的选择、用于识别危害的参考文献或原始试验数据等。
▌风险评估
在使用PDE或ADE值时,按照以下危害递增原则(红色为最高危险)建立标准并对产品进行评估:

一旦完成基于健康的评估并确认 HBEL,应通过质量风险管理流程使用这些数据,以确定需要实施哪些控制措施,并评估现有的组织和技术控制措施是否足够或者是否需要补充。
预计对于对患者/动物具有较高潜在危害的产品,将需要更详尽的组织和技术控制措施。
如果控制措施不能充分确保潜在污染一直控制在低于 HBEL 的水平,那么相关产品应在专用设施中生产。
▌杂质限度控制
例如,对于有实际阈值证据的致突变杂质的监管,在可获得相关数据的前提下,可通过计算PDE来确定可接受暴露量,从而制定可行的限度。
评估要求
2020年,国际检查合作组织(PIC/S)发布《基于健康的暴露限值(HBEL)的评估及其在质量风险管理中的使用的检查备忘录》,针对HBEL评估报告内容及评估人员资质提出如下要求:
▌评估报告内容要求
涵盖决策、论证过程及 HBEL 数值;
包含评估人员的签名及日期,并附上或引用其个人简历;
列出评估过程中参考的所有文献资料;
明确记录所采用的检索策略;
展示检索结果,并对结果进行详细评论;
根据产品的非临床数据和临床经验,明确用于 HBEL 计算的关键反应及其最低剂量;
给出调整相关系数的明确理由(基于科学和法规原则)。
▌评估人员资质
评估人员的简历需证明其具备相关资质(如药学、药理学或其他药物科学学位);
拥有毒理学背景;
在基于健康的暴露评估领域具备丰富经验。
*注:缺乏上述经验而仅凭自学HBEL知识,将不被视为充分资质。
推荐阅读 | PDE评估详解:PDE评估与PDE计算的差异与联系,及如何编制一份合格的PDE评估报告
OEL:职业暴露限值
OEL(Occupational Exposure Limit,职业暴露限值),是指某种污染物的最大空气悬浮粒子浓度,在该浓度下几乎所有工人能够日复一日的反复接触该污染物,且不会造成不良反应。通常以每天 8 小时的时间加权平均值来表示,常用单位为 µg/m³。
根据ISPE发布的《ISPE基准指南 第7卷-基于风险的制药产品生产》(ISPE Baseline Guide Vol 7 - Risk-Based Manufacture of Pharmaceutical Products),OEL计算公式如下:
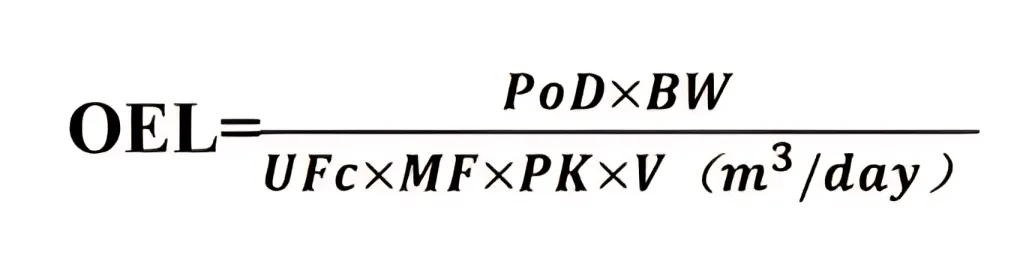 推荐阅读 | OEL计算详解:OEL是什么?OEL值如何计算?如何撰写一份科学可靠的OEL报告?
推荐阅读 | OEL计算详解:OEL是什么?OEL值如何计算?如何撰写一份科学可靠的OEL报告?
应用场景
▌风险评估与监测
OEL作为基准值,用于评估工作场所中空气传播产品对工人的暴露风险,确保长期接触下的健康安全性。
▌生产合规与工程控制
在生产环节,OEL不仅是企业的内控标准,帮助企业科学选择并实施工程控制措施,如通风系统、防护设备等,以减少工人对有害物质的暴露,确保生产合规性。
▌药品共线生产风险管理
在药品共线生产环境中,特别是当缺乏特定的HBEL时,OEL成为评估共线生产风险的关键参考,用于指导清洁验证过程,确保高毒高活性药物的生产不会引发交叉污染。
▌工人职业健康监护
OEL是制定产业工人的健康防护设施和措施的重要参考标准。
OEB:职业暴露等级
OEB(Occupational Exposure Band,职业暴露等级),是指对危害潜能渐增的生物制品或化合物的健康危害分类系统,根据化合物的药理或毒理特性,制定OEB的目是为各个产品生产选择合适的生产设施和操作规程,制定一个分级标准。
OEB分级与OEL数值存在如下对应关系:
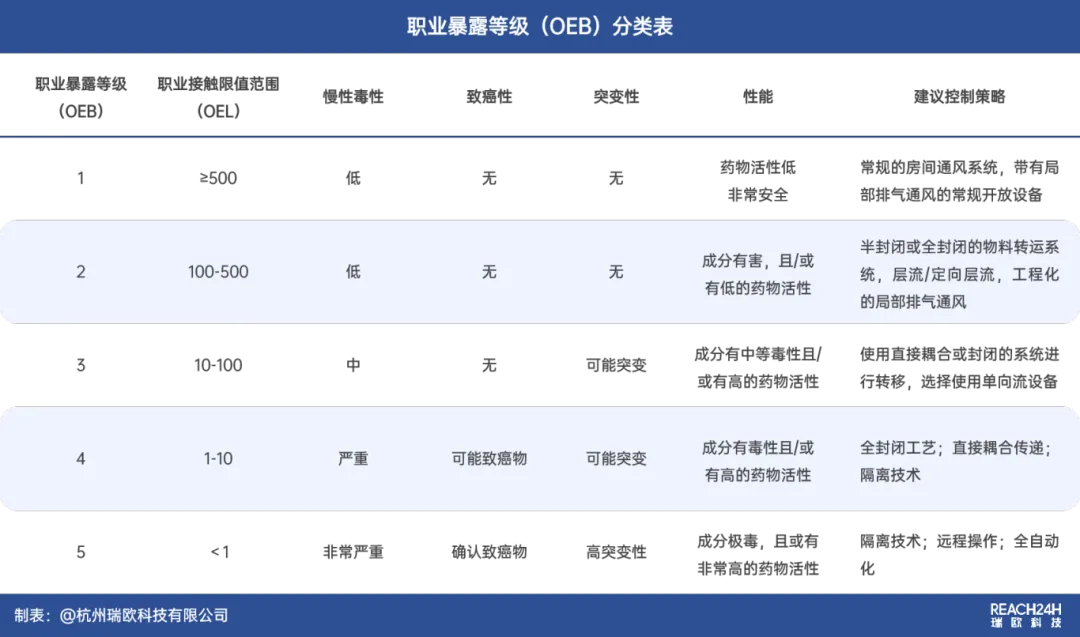
OEB等级越高,表示化合物的危害程度越大,所需的OEL值也越低。
其中,OEB 5级化合物属于最严重的等级,适用于高活性、高毒性或具有遗传毒性、致癌性的活性药物成分,其OEL通常小于1 μg/m³,或PDE小于10 ug/天,控制其职业接触非常困难。
▌高活性药物
基于质量风险管理考量,高活性药物的定义尚无统一标准,且全球制药企业对其分类体系各有差异。基于现有的法规和指南,高活性药物的定义如下所示:

推荐阅读 | 高活性药物详解:HBEL/PDE解析:什么是高活性药物?如何判定?相关药品如何共线生产?
常见问答
是否所有的药品都要进行HBEL评估?
是的,根据2018年EMA发布的《交叉污染和共用设施清洁限度指南问答》,用于计算HBEL的毒理或药理数据需要在药品生命周期中定期评估,简而言之,即所有药品都需要建立HBEL。
LD50能够推导计算PDE吗?
LD50的数值大小与NO(A)EL或PDE并没有直接数量关系,因此,基于LD50进行的HBEL或PDE评估当前并不容易被官方接受。
OEL可以推导计算PDE吗?二者是10倍关系吗?
PDE与OEL在暴露途径、保护的目标群体存在差异,导致公式中PK与UFC取值有所不同,虽然在公示上只是一个V的差别,但并不是简单的10倍关系。
人类临床数据可以用于计算PDE吗?
可以,根据EMA指导原则中的计算案例,使用人类临床数据与动物毒理学数据的计算逻辑是一致的。然而,在基于治疗剂量的临床数据计算PDE时,仍需进行专业的评估和判断。
1/1000最低日治疗剂量可以用于计算清洁验证限度吗?
不可以,1/1000最低日治疗剂量仅与药物的疗效有关,而与药物的安全性没有直接关系。
关于瑞欧佰药
瑞欧佰药隶属于瑞欧科技旗下,拥有一支由20余位毒理学家组成的专家团队,成员包括中国认证毒理学家(DCST)和美国认证毒理学家(DABT),专业领域覆盖药品、化学品、化妆品等多个关键行业。
在药品研发与注册服务领域,瑞欧佰药凭借对全球药品法规的深入理解和坚实的毒理学研究沉淀,构建了一套与国际标准接轨的药品PDE评估方法体系,已经为国内外药企提供了上千次的高质量咨询与评估服务。
在此基础上,瑞欧佰药进一步发挥其专业优势,自主开发了国内首个PDE数据库,助力制药企业、药品研究机构和监管部门轻松、全面地应对PDE数据管理挑战,为药品共线生产和职业安全管理提供强有力的技术支持。







 化学品合规
化学品合规
 化妆品合规
化妆品合规
 检验检测
检验检测
 安全管理智能化
安全管理智能化
 绿色低碳可持续
绿色低碳可持续
 药品合规
药品合规
 食品合规
食品合规
 食品接触材料/再生塑料
食品接触材料/再生塑料
 中国农药登记
中国农药登记
 境外农药登记
境外农药登记