自2023年3月CFDI发布的《药品共线生产质量风险管理指南》正式稿(以下简称指南)发布以来,基于健康的暴露限度(HBEL)引发了医药相关行业和监管机构的广泛关注、学习和研究。
PDE计算与PDE评估
我们注意到,目前业内对PDE评估的关注点主要集中在PDE计算,计算主要依据指南和ICH Q3C提到的公式。
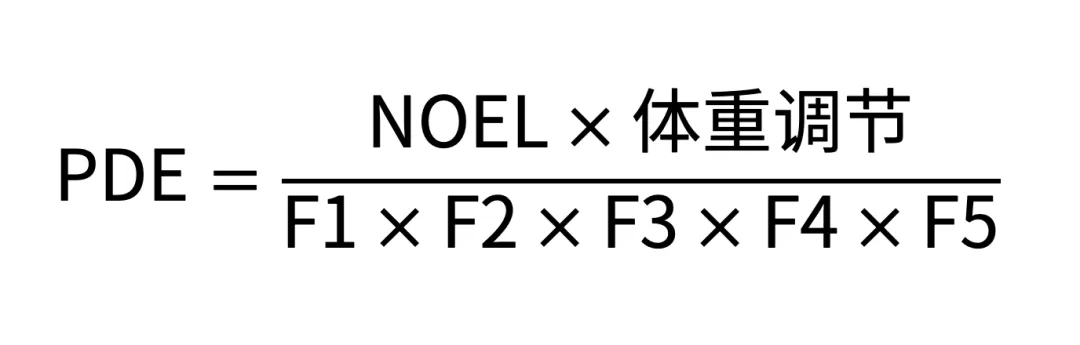
PDE计算首选NOEL值,在没有NOEL值时,可以选用LOEL。但对于二者的选取,业内往往存在不小的疑惑。
由于部分化合物的NOEL或LOEL不易获取,而LD50较易获取,有些计算则采用LD50/2000这种存在明显科学性不足的方式得出NOEL,那么由此得到的PDE值,自然也是不可靠的。
而有些企业则根据自己进行的试验结果或是网上查到的某个NOEL或LOEL数值进行计算,该方法缺乏整体的逻辑性和系统性,大概率依然无法得出目标物质可靠的PDE数值。
究其原因,就在于PDE评估与PDE计算的差异。
因为即使假设所有校正因子的取值具有合理性,这种方式只能得出针对某一试验的PDE数值,而非目标物质科学的PDE数值。
很多情况下,根据不同试验计算的同一物质的PDE数值差异可达数倍甚至几十上百倍。
总而言之,脱离PDE整体评估的PDE计算结果是不够可靠的,且不会被官方认可。
至此,我们需要明确的是,PDE计算只是PDE评估的一部分,合理且科学的PDE计算必须建立在全面且质量良好的PDE评估报告中。
PDE评估报告
EMA/CHMP/CVMP/SWP/169430/2012、EMA/CHMP/CVMP/SWP/246844/2018、PIC/S PI 046-1、PIC/S PI 053-1、PIC/S PI 052-1、ISPE的Risk-MaPP等多份行业相关指导原则中关于PDE报告的规定可以得知,一份全面且质量良好的PDE报告,应由以下6个部分组成:
1. 在报告起始位置进行评估概要论述。
2. 全面的文献检索,评估所收集信息的相关性、充分性和可靠性。关键试验应来源于原始参考文献,并就其质量(试验设计/结果描述/报告准确性等)进行审查。药物审评机构是获取信息的良好渠道,而来源于安全数据表(SDS)的信息需谨慎对待,因为不同来源的SDS的信息可信度差异较大。
3. 记录评估过程,包含但不限于:
通过审查该物质所有相关药理毒理等数据(所有可用的动物和人体数据)进行危害识别;
识别“临界效应”;
确定被认为是临界效应的PoD;
使用多个校正因子来考虑各种不确定性;
用PoD计算PDE;
参考文献或原始试验数据等;
4. 包含必要信息的描述,目标物质的基本信息、用途和作用机制、药效学和药代动力学、动物数据(急性毒性、局部毒性、致敏性、重复剂量毒性、生殖发育毒性、遗传毒性、致癌性等)、人体数据(临床使用、不良反应报道、敏感人群等)等。
5. 毒理学专家签名和简历。
6. 报告完成日期。
此外,PDE报告还需定期再审查,必要时重新再评估。由此可见,PDE评估是一个需要专业知识的系统性评估过程。
正如EMA、PIC/S、ISPE指导原则等的要求,起草报告人员应在毒理学/药理学方面具备足够的专业知识和经验,在药品相关领域及PDE评估方面具有丰富的经验,并且是具有资质证书的毒理学家等。
写在最后
一份全面且质量良好的PDE报告一方面便于企业内部沟通,另一方面便于迎接监管机构进行检查。
若对PDE评估有需求,委托专业机构出具PDE评估报告是最为稳妥的方式。
瑞欧佰药在瑞欧科技多位从事计算毒理性评估的专家团队的基础上,结合多年的药品、农药、环境化学等多方面的评估经验,由药品研发、注册申报、合规管理等领域多位专家的共同协作下,依据相关法规原则,为制药企业提供专业、高效、可靠的 HBEL 评估服务,包括PDE、ADE和职业接触限值(OEL)评估。
关于基于健康的暴露限度(HBEL)和 PDE计算,瑞欧佰药已撰写一系列解读文章:
人类临床数据可以用于PDE评估和PDE计算吗?依据在哪?又有何优势?
最新《清洁验证技术指南(征求意见稿)》拟规范PDE报告等清洁验证细节
OEL可以推导计算PDE吗?PDE与OEL有什么区别?适用范围有哪些?
一文解读 | LD50能够推导计算PDE值吗?方法是否科学?官方是否认可?








 化学品合规
化学品合规
 化妆品合规
化妆品合规
 检验检测
检验检测
 安全管理智能化
安全管理智能化
 绿色低碳可持续
绿色低碳可持续
 药品合规
药品合规
 食品合规
食品合规
 食品接触材料/再生塑料
食品接触材料/再生塑料
 中国农药登记
中国农药登记
 境外农药登记
境外农药登记