OTC(Over-the-counter)药物,是指不需要医生处方即可购买到的药品,又称非处方药。
在美国,有80多类OTC药物受美国FDA(美国食品药品监督管理局)管控,范围涵盖痤疮药物到手消毒产品。目前在美国市场上销售的OTC药物超过30万种,OTC产品在美国的医疗保健系统中扮演着越来越重要的角色。
如何注册美国OTC产品
美国OTC药品的注册有2种途径:
❶ 新药物申请:是指活性成分的安全性和有效性是未知或未被认可的。这类产品在上市前需要获得FDA的预批准(pre-approval)。通过这个途径申请需要有完整的药物应用档案,包括临床试验,以证明其安全性和有效性。
❷ OTC专论(OTC Monograph):是指活性成分通常被认为是安全有效的(Generally Recognized as Safe and Effective,GRASE)。专论中概述了对这类产品的限制,包括有效成分、标签以及其他的一般要求。如果产品符合专论中的要求,则不需要FDA的预批准。
OTC专论药物要求
一般来说,美国FDA会统一审查用于OTC药品的活性成分,并最终出具一份OTC专论(OTC Monograph)。
OTC专论就相当于活性物质标准。对于OTC产品,只要其中的活性成分满足OTC专论的要求,就可以不经FDA审批直接上市。
但需要注意的是,不用FDA审批并不意味着OTC药品上市没有任何合规义务,产品仍需要满足一定的要求,具体的要求如下:
OTC药品里的活性成分必须有现成的OTC专论,并且企业所用的活性成分符合OTC专论的要求,否则产品就要做OTC新药申请。
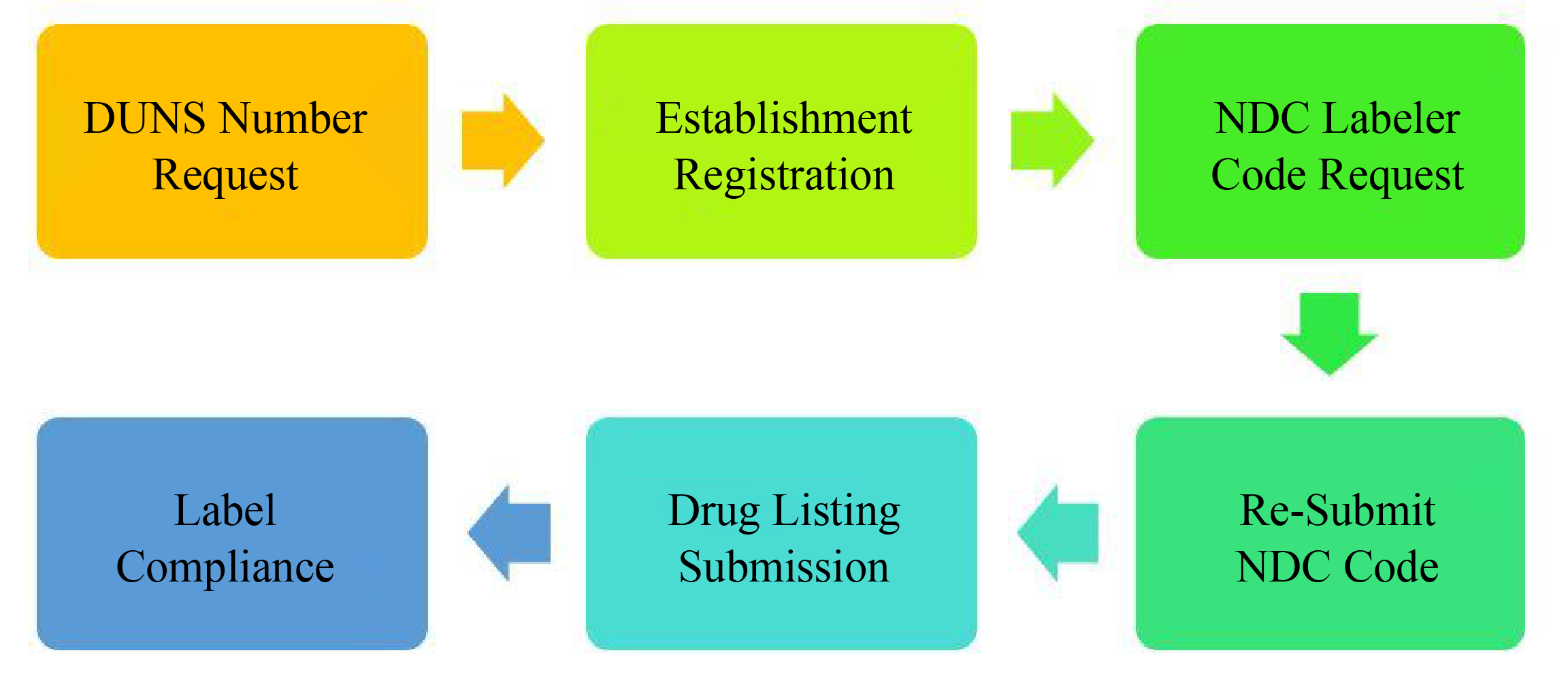
OTC药品的生产商或进出口商必须进行FDA厂址登记,对美国境外的企业来说,则需要委托美国境内的代理进行FDA厂址登记。
为OTC药品申请一个国家药品编号NDC(National Drug Code)。
企业必须把将要进入美国市场的所有OTC药品列出清单并在FDA进行备份,之后此清单每年至少要在6月和12月更新两次。
OTC药品的标签必须符合相应的标签规定。
生产工厂必须满足动态药品生产管理规范(cGMP)的要求
OTC专论药物注册流程
我们的服务
申请DUNS号码
FDA药物生产场所登记
OTC配方标签审核
产品注册
年度产品更新
相关阅读推荐:






 化学品
化学品
 食品接触材料
食品接触材料
 化妆品
化妆品
 绿色双碳
绿色双碳
 境外农药登记
境外农药登记
 中国农药登记
中国农药登记