随着《药品共线生产质量风险管理指南》等法规要求药品共线生产评估中,需采用基于HBEL的毒理学计算方法,高活性药物的识别与判定成为部分制药企业面临的挑战。
然而目前,高活性药物的定义尚无统一标准,且全球制药企业对其分类体系各有差异。
法规现状
基于质量风险管理考量,官方尚未对高活性药物给出一个具体的定义。
EMA认为风险在一个连续的尺度上变化,没有确定的截止点,风险应按比例进行控制。在Quality Risk Management研究中应使用实际的HBEL值,以确定所需的实际控制(EMA/CHMP/CVMP/SWP/246844/2018)。
ISPE也指出相较于提供具体的方法来识别高危药物,确定药品制造过程中可接受风险的方法更为合适(ISPE Baseline Guide Vol 7: Risk-Based Manufacture of Pharma Products 2nd Edition)。
但对于制药企业而言,在实际生产过程中,基于药理毒理分析及计算所得的PDE、OEL值对高活性/非高活性药物进行划分管理仍是必要的。
相关定义描述
首先,我们从现有的法规和指南中梳理了目前对于高活性药物的各种定义描述:
ICH Q7

生产高致敏性药品,如青霉素类或头孢类药物等;高活性或高毒性物质(如某些激素类物质或细胞毒性抗肿瘤物质)应采用专用的生产区域。
ISPE Baseline Guide Vol 7: Risk-Based Manufacture of Pharma Products 2nd Edition

已知或极有可能对人类具有致癌性的基因毒性化合物、低剂量即可对生殖和/或发育产生影响的化合物以及低剂量即可产生严重靶器官毒性或其他重大不良影响的化合物。
EMA在2016年关于 EMA/CHMP/CVMP/SWP/169430/2012的问答

已知或极有可能对人类致癌的具有基因毒性(特别是致突变性)的化合物。
低剂量下可产生生殖和/或发育影响的化合物。
低剂量下可产生严重靶器官毒性或其他显著不良反应的化合物。
具有高药学活性的化合物。
具有高致敏潜力的化合物。
《中国制药工业EHS指南(2020年版)》
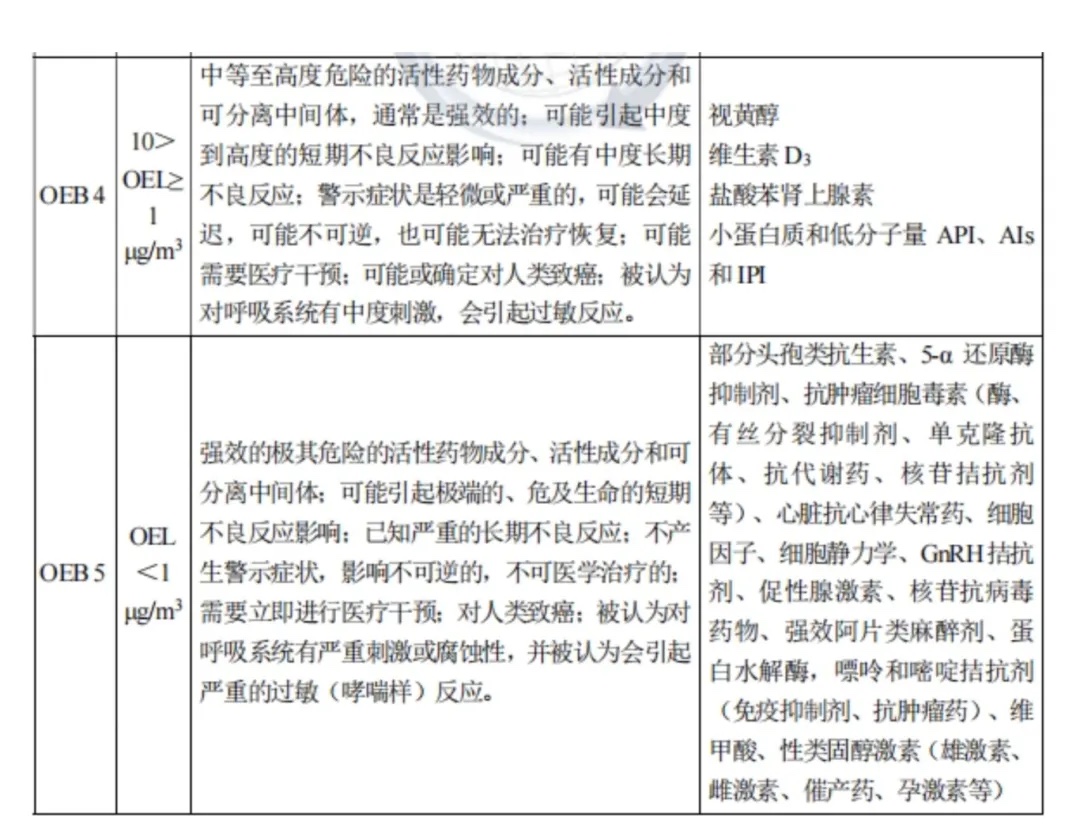
1≤OEL<10 μg/m³ 或 OEB 4:中等至高度危险的活性药物成分、活性成分和可分离中间体,通常是强效的。
OEL<1 μg/m³ 或 OEB 5:强效的极其危险的活性药物成分、活性成分和可分离中间体。
《药品共线生产质量风险管理指南》

案例一:企业在已有生产线和生产设备引入的新产品B时,经计算该产品的PDE值小于等于10 μg/天或OEL值小于等于1 μg/m3,经评估企业将该产品按照高毒高活产品管理,使用专用设施、专用设备、一次性使用技术或密闭设备进行生产,以避免和减少对其他产品的影响。
案例二:企业在已有生产线和生产设备引入的新产品C时,经计算该产品的PDE值处于100 μg/天~10 μg/天之间的或OEL值处于10 μg/m3~1 μg/m3之间的,经评估将该产品按照潜在的高毒高活产品(可能的高毒高活产品)管理,并对共线生产应当采取的防止污染和交叉污染的措施进行分析和评估。
综上,关于高活性药物的定义汇总,如下图所示:
分类维度 | 定义描述 | 参考法规/指南 |
药理毒性 | 对人类具有致癌性的基因毒性(或致突变)化合物;高致敏化合物; 低剂量下可产生严重靶器官毒性或其他显著不良反应、生殖和/或发育毒性的化合物; 具有高学活性的化合物 | ICH Q7;ISPE Baseline Guide Vol 7: Risk-Based Manufacture of Pharma Products 2nd Edition; EMA 在2016年关于EMA/CHMP/CVMP/SWP/169430/2012的问答 |
PDE值 | ≤10 μg/天或处于100 μg/天~10 μg/天之间 | 《药品共线生产质量风险管理指南》 |
OEL值 | ≤1 μg/m3或处于10 μg/m3~1 μg/m3之间 | 《中国制药工业EHS指南(2020年版)》; 《药品共线生产质量风险管理指南》 |
OEB | 4 或 5 | 《中国制药工业EHS指南(2020年版)》 |
共线生产建议
《药品共线生产质量风险管理指南》(以下简称“指南”)中指出:在特殊情况下,某些激素类、细胞毒类、高活性化学药品不可避免共用同一生产设施和设备生产的,应当采取特别防护措施。因此,瑞欧佰药建议企业:
药品生产企业应当基于科学和风险,使用具有科学性和代表性的工具,如基于健康的暴露限度(HBEL)或其他毒理学、药理学数据工具,制定高毒高活药品的分类分级标准,对于不同毒性和活性的药品生产应当采取不同的科学合理的控制措施。
在评价HBEL时,除了参考PDE/ADE值对高毒高活产品进行生产风险控制,指南中也指出可以考虑对于已有生产线和生产设备引入的新产品按照职业接触限值(Occupational Exposure Limits, OEL)进行分级。
评估HBEL时,需要有专业的毒理学家参与。计算PDE时涉及到NOAL或LOEL的选择,校正因子F1~F5的取值等往往需要从业人员具有足够强的专业知识支撑,积累了一定量的科学经验,能够从现有的庞杂毒理学数据中合理、高效地选择出有效信息。
对于潜在的高毒高活产品,制药企业需要科学地评估其共线生产如何安排,可以采取阶段性生产,清洁验证,生产后进行清洁确认等有效的预防和控制措施进行共线生产,而并非不能共线。
写在最后
如果制药企业在药品生产的风险评估以及与官方沟通中存在问题,可以随时联系瑞欧佰药。
瑞欧佰药在上述方面具备足够的专业度和丰富的经验,团队中拥有多名资深毒理学评估专家,致力于为客户提供专业和可定制化的药品合规服务和技术服务。
至今,瑞欧佰药出具的PDE/ADE/OEL报告已得到复星医药、广药白云山、上药集团、华海药业等行业巨头的青睐,成功助力多家企业顺利通过各类审计与官方检查,累计交付的PDE评估报告超过1000份,其专业性与可靠性得到了业界的广泛认可。
关于基于健康的暴露限度(HBEL)和PDE计算,瑞欧佰药已撰写一系列解读文章:
制药企业必读!PDE评估与PDE计算的差异与联系,及PDE评估报告详解
人类临床数据可以用于PDE评估和PDE计算吗?依据在哪?又有何优势?
最新《清洁验证技术指南(征求意见稿)》拟规范PDE报告等清洁验证细节
OEL可以推导计算PDE吗?PDE与OEL有什么区别?适用范围有哪些?
一文解读 | LD50能够推导计算PDE值吗?方法是否科学?官方是否认可?







 化学品合规
化学品合规
 化妆品合规
化妆品合规
 检验检测
检验检测
 安全管理智能化
安全管理智能化
 绿色低碳可持续
绿色低碳可持续
 药品合规
药品合规
 食品合规
食品合规
 食品接触材料/再生塑料
食品接触材料/再生塑料
 中国农药登记
中国农药登记
 境外农药登记
境外农药登记