杂质的研究是药品研究的重要内容,药品中的杂质大多具有潜在的生物活性,有的甚至与药物相互作用从而影响药物的有效性和安全性,严重的可能产生特殊的毒性作用。
药品中的杂质是否进行了完整的研究,是否得到了合理、有效的控制,直接关系到药品的质量可靠性和安全性,杂质的研究贯穿于整个药品研究的全过程。
三种药物中常见的杂质:
化学药物往往经过多步化学反应得到,工艺过程中包含一个或多个起始物料及中间体,涉及多种试剂/溶剂的使用,工艺过程中发生的各种副反应导致了多种引入杂质的可能性,此过程中产生的杂质习惯性称为工艺杂质。
药物在储存过程中由于受到温度、湿度、光照等外界条件的影响或者受到微生物的作用,可能在此过程中产生杂质,此过程中产生的杂质习惯性称为降解杂质。部分杂质由于结构的特殊性,在工艺过程及降解途径中均有可能产生,此杂质的研究和控制需要考虑更多因素。
化学药物工艺杂质中,由于部分杂质结构的特殊性,在较低的残留水平下即可直接造成DNA损伤,进而导致DNA突变并可能进一步引发恶性肿瘤,对药品的安全性造成重大影响,当前称为(潜在)遗传毒性杂质。对于此类杂质,在2000年版的欧洲药典中,明确提到需要控制具有遗传毒性磺酸酯类杂质,开启了关注遗传毒性杂质风险评估和控制的新时代,2014年6月,ICH M7在第四阶段获得执行委员会批准,并推荐监管机构采纳,标志着ICH成员国对遗传毒性杂质的评估和控制初步达成共识,并为遗传毒性杂质的识别、分类、定性和控制提供了实用的指导和框架。
其中,遗传毒性杂质的研究和控制主要包括如下内容:
杂质识别
警示结构单元是遗传毒性杂质识别的起点。所谓警示结构单元是指一些具有与遗传物质发生化学反应能力的特殊结构单元,会诱导基因突变或者导致染色体重排或断裂,从而具有潜在的致癌风险。具有警示结构单元,但并未经实验测试模型验证的杂质叫做潜在遗传毒性杂质。常见警示结构单元模拟整合实例如图所示:
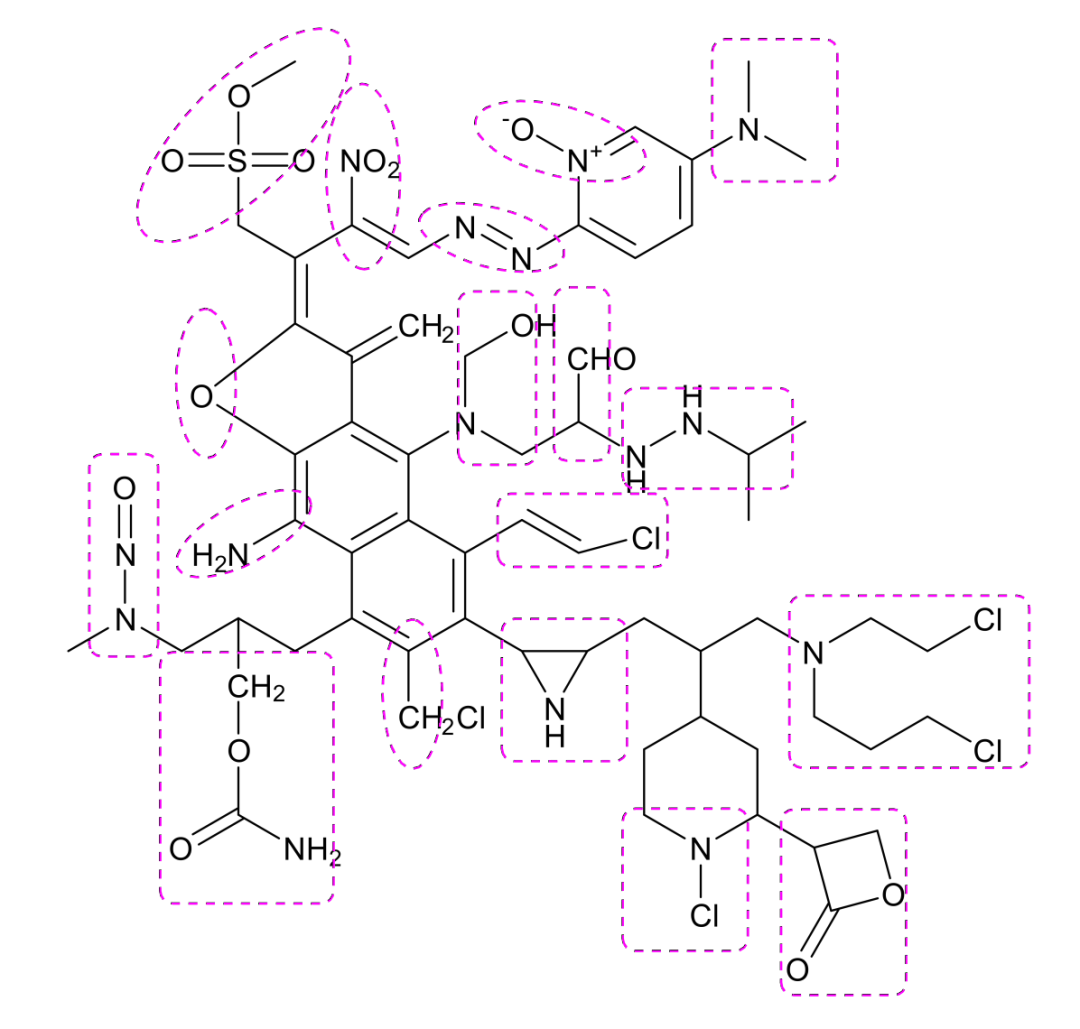
杂质分类
一般情况下,遗传毒性杂质具备警示结构单元、诱变性、致癌性三大特征,ICH M7根据诱变性和致癌性及其控制策略将杂质分为五类。
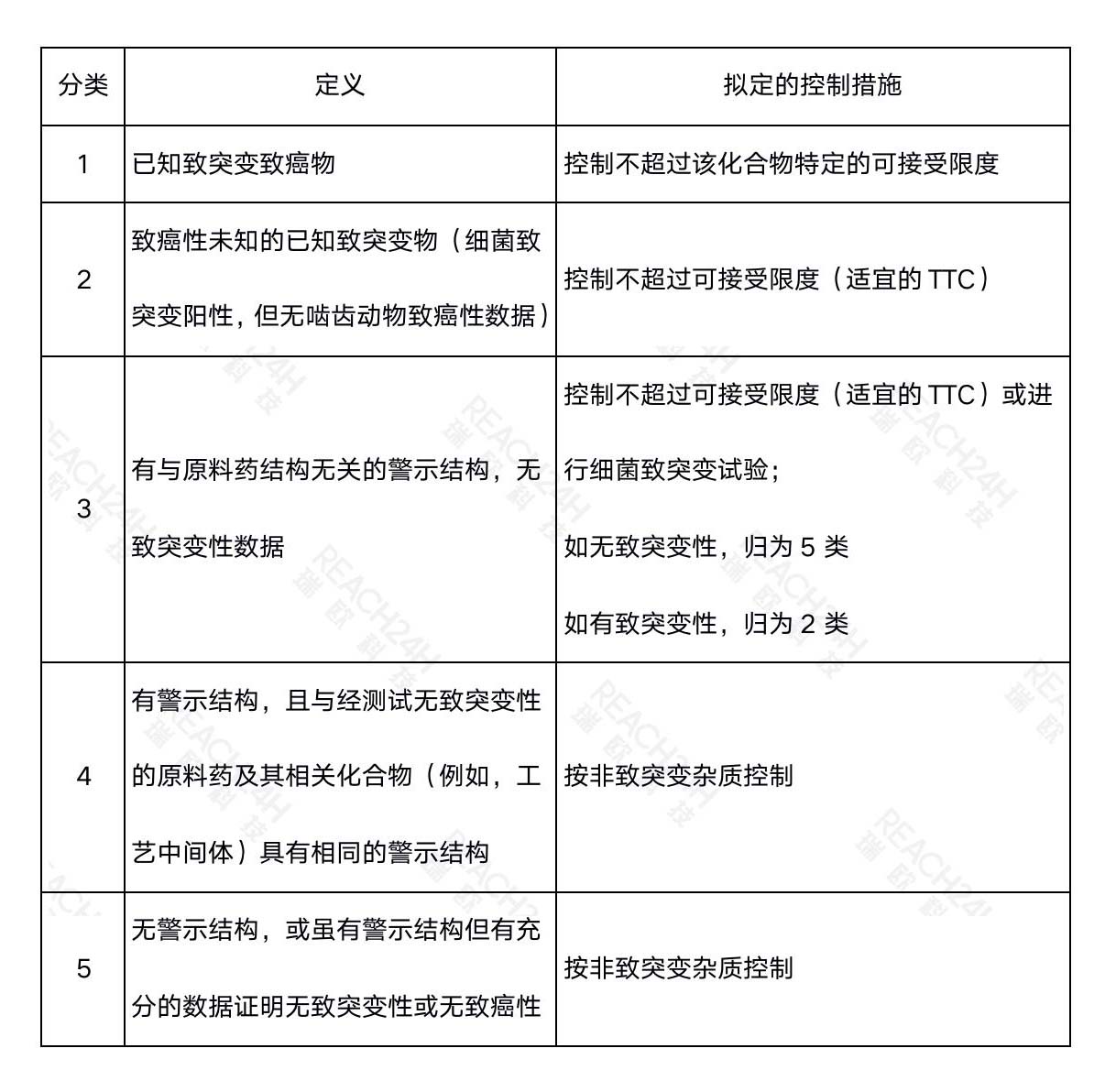
杂质控制限度
遗传毒性杂质的控制限度计算方式主要有如下3种:
方法1: PDE(Permitted daily exposure),每日摄入药物中杂质的可接受最大摄入量。本法适用于有阈值效应的遗传毒性杂质,即超过一定限度时才会产生遗传毒性的杂质。首先可通过文献检索获得杂质的PDE值,或根据相关动物的未见效应剂量(NOEL)计算可接受的最大日剂量(PDE)。
具体计算方法见ICHQ3,再根据药品的最大日剂量计算出杂质的接受限度,计算公式如下:
可接受限度(ppm)=1000*PDE/剂量
方法2: Threshold of Toxicological Concern (TTC) :毒理学关注阈值,也叫做可接受风险的摄入量。即相当于每天摄入1.5μg的遗传毒性杂质,被认为对于大多数药品来说是可以接受的风险,可使一生中致癌的风险小于1/105。一般的遗传毒性杂质均可按此限度进行控制。
当运用已建立风险评估方法所需资料缺乏时,包括致癌性长期试验资料或提供遗传毒性阈值机制证据的资料等,建议采用毒理学关注阈值(TTC)所定义的普遍适用方法。短期暴露(Less-Than-Life, LTL)等特定情况下有理由提高限度,控制限度可经引入额外的安全因子(Safe Factor,SF),按照额外增加致癌风险的1/107至1/105进行遗传毒性杂质限度制定。LTL的治疗时长与控制限度关系如图所示:
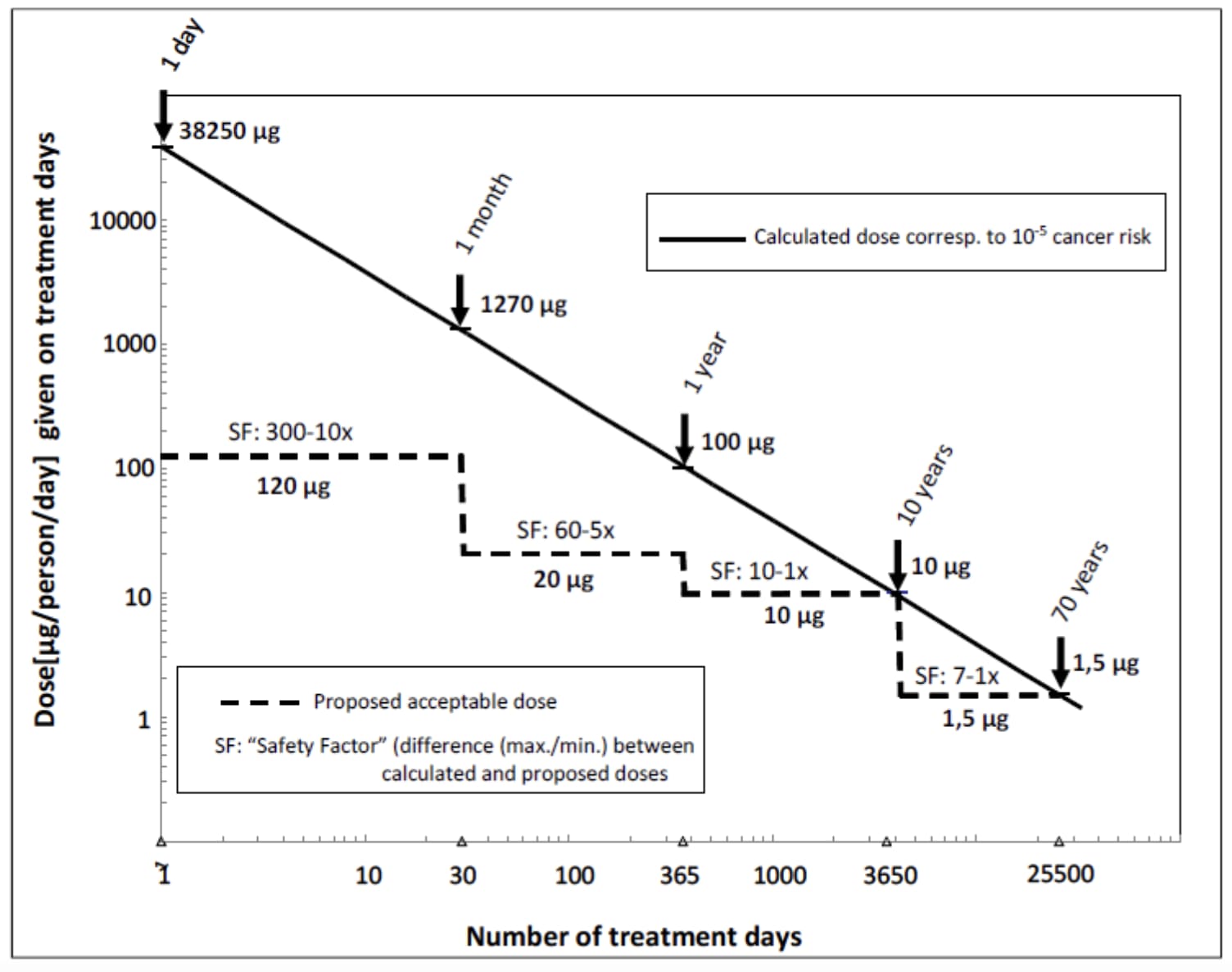 图来源于ICH M7(R1)
图来源于ICH M7(R1)
方法3:Acceptable Intake(AI),对于动物毒性试验数据较为完整的杂质(如数据来源于CPDB、NTP、WHO等),可以从最敏感物种的最敏感部位的50%肿瘤发生率(TD50),经过简单的线性外推至1/105的肿瘤发生率。
计算举例:环氧乙烷
根据致癌性数据库(CPDB数据库官方名称),环氧乙烷的TD50为21.3 mg/kg体重/天(大鼠)和63.7 mg/kg体重/天 (小鼠)。在计算可接受摄入量时,采用了剂量较低的大鼠值(即更保守)。
为推导十万分之一致癌率的剂量,将该值除以50,000:
21.3mg/kg体重/天÷50,000=0.42μg/kg体重/天
推导人类每日总摄入量:
0.42μg/kg体重/天×50kg体重=21.0μg/天
杂质控制方法
方法1:
原料药质量标准中包含杂质检查项,采用合适的分析方法将杂质控制在可接受限度以内。
方法2:
在原料、起始物料或中间体的质量标准中包含杂质检查项,或作为过程控制项,采用合适的分析方法将杂质控制在可接受限度以内。
方法3:
在原料、起始物料或中间体的质量标准中对杂质进行检测,或进行过程控制,制订一个高于原料药中该杂质可接受限度的标准,使用合适的分析方法并结合对杂质去向和清除的认知,及相关的工艺控制,保证原料药中的杂质的水平低于可接受限度而无需在后续工艺中再行检测。
方法4:
明确工艺参数及其对残留杂质水平的影响,确信原料药中的杂质水平将会低于可接受限度,则建议无需对该杂质进行分析检测。
瑞欧佰药的服务:
瑞欧佰药技术团队有多位药品研发领域和申报领域的资深专家,具备多年的化学药物研究开发经验及多个成功的产品开发、申报及补充研究经验,团队有多位获得认证的中国毒理学家(DCST)和欧洲注册毒理学家(ERT),在毒性评估方面具有丰富的经验。
在深刻理解ICH等法规要求的基础上,结合Derek & Sarah数据库,基于ICH M7的规则,结合当前CDE的审评要求,为客户推荐经济、高效、完整、可靠的遗传毒性杂质研究方案和控制策略方面的建议,提供以下遗传毒性杂质研究服务:
根据工艺,基于反应原理,推导筛选可能存在的潜在遗传毒性杂质谱;
通过授权使用官方认可的Derek Sarah数据库,同时采用两种互补的(Q)SAR数据库进行预测,快速、有效地为客户提供杂质的潜在遗传毒性预测、分类等服务;
根据预测及分类结果,结合客户产品的具体信息,进行整体研究/控制策略的制定,并进行初步控制限度计算;
对于部分特定杂质,进行充分的毒理学数据查询,依据已有数据进行放宽控制限度的可能性确认;
遗传毒性杂质的检测方法开发与验证,对方法进行系统适应性、专属性、检测限、定量限、线性和范围、准确度、精密度、溶液稳定性、耐用性等考察和验证, 为遗传毒性杂质含量检测提供可靠的检测控制手段;
样品检测。
作者介绍
郭家强先生,毕业于兰州大学化学系有机化学专业,拥有近20年化学药物研发、申报及项目管理经验。曾就职于知名药企及研发服务机构,参与或领导多个产品的开发至申报上市全过程,熟悉ICH及CDE发布的相关指导原则和法规要求。目前担任瑞欧佰药药品研究技术专家。







 化学品合规
化学品合规
 化妆品合规
化妆品合规
 检验检测
检验检测
 安全管理智能化
安全管理智能化
 绿色低碳可持续
绿色低碳可持续
 药品合规
药品合规
 食品合规
食品合规
 食品接触材料/再生塑料
食品接触材料/再生塑料
 中国农药登记
中国农药登记
 境外农药登记
境外农药登记