根据美国联邦管理法规定,药品进入美国前,必须向美国FDA申请注册并递交有关资料,化学原料药需按要求提交一份药物管理档案,被称为药物主文件(Drug Master File,DMF)。
DMF是由生产商提供的某药品生产全过程的详细文件,旨在帮助FDA全面了解该厂产品的生产情况。
文件内容包括:生产、加工、包装和贮存某一药物时所用的具体厂房设施和监控的资料。这些资料共同证明了药品的生产过程严格遵循了GMP(良好生产规范),从而确保了药品的质量和安全性。
DMF文件类型
DMF文件共有以下五种类型:
类型 | 明细 |
Ⅰ型 | 生产地点和厂房设施、人员 |
Ⅱ型 | 中间体、原料药和药品 |
Ⅲ型 | 包装物料 |
Ⅳ型 | 辅料、着色剂、香料、香精及其他添加剂 |
Ⅴ型 | 非临床数据资料和临床数据资料 |
注意,现阶段已不提供 I 型备案登记。
DMF备案流程
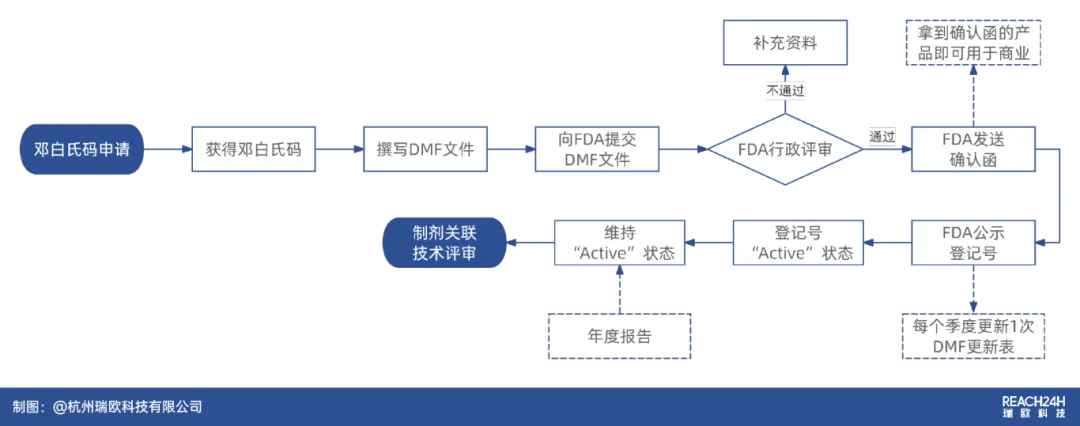
DMF备案的意义
美国DMF文件库是全世界制剂厂家广泛参照的一个供应商资源库,对于希望将产品推向国际市场的原料药厂家而言,进行DMF备案至关重要。
原料药若要在美国市场合法流通,必须获得FDA的认可。通常,这一过程始于获取DMF登记号。
此后,在制剂生产商向FDA提交注册申请时,可直接引用原料药对应的DMF登记号作为其资料的一部分,并在后续的现场检查中接受审核。
在FDA正式批准制剂申请前,原料药生产企业必须通过FDA官员的现场检查。检查旨在验证原料药生产现场是否符合国际协调会议ICH Q7 GMP标准(同时需满足FDA特定的技术要求),并确保生产现场与提交的DMF内容保持一致。
原料药DMF备案常见问答
生物类制品(培养基,细胞株,外泌体等)属于DMF备案的第几类?
答:均属于DMFⅡ类。
答:DMF当前申报最低是参考USP,对于是否是GMP没有强制,但是否是GMP关系到产品后续推广问题。对于物料来源公司无具体硬性要求,通常的话,如果有体系证书的话会更好。
质量标准怎么制定?
答:一般是参考USP一些法定标准,然后包括同行的这个质量标准。要求厂家明确各项目设定的考虑,总结分析各检查方法选择以及限度确定的依据。与已上市产品进行了质量对比研究,需提供相关研究资料及结果。
DMF过程中对厂房有哪些要求?未来拿到DMF后应对飞行检查有哪些要求?
答:一般只有原料药厂家才会接受现场FDA检查,原料公司通常提供资质证明,如果有体系证书也可提供。无具体硬性要求。
DMF提交获得备案号以后,要如何维护?
答:DMF不是编好了一个版本,获得备案号后就一劳永逸了,它需要按客户的要求以及工艺和设施变更的情况不断地修改补充完善,重大的变更必须通知客户。FDA要求,即使没有变更,每年也需要递交一份没有变更的声明。
从接受资料到提交、到DMF回复流程的大致周期?
答:瑞欧佰药对卷宗资料分析大概是5-10工作日,卷宗制作提交一般是15工作日,如果有行政缺陷回复的话这个周期最多延长到30个工作日,翻译的话也需要5-10个工作日,具体一般要35-50个工作日。
在资料的分析、制作、审核、翻译、提交的过程中,瑞欧佰药与客户交流的情况和频率是怎么样的?
答:瑞欧佰药在项目启动后,会给到客户一份计划表,包括每个阶段的预估时间和双方的联系方式;另外每周我们都会撰写周报,内容包括本周工作内容和下周计划及时更新项目进度,并且将此份周报邮件发送给客户并抄送给此项目的相关人员。
关于美国DMF登记,瑞欧佰药可提供如下服务:
指导厂家准备DMF文件所要求的中文资料;
翻译制作DMF英文文件;
提交DMF文件并与FDA进行技术联络;
指导厂家准备生产现场,包括硬件和软件;
提供现场检查迎检培训;
提供现场翻译;
对厂家进行ICH Q7以及cGMP特定要求的专项培训。
相关阅读:







 化学品合规
化学品合规
 化妆品合规
化妆品合规
 检验检测
检验检测
 安全管理智能化
安全管理智能化
 绿色低碳可持续
绿色低碳可持续
 药品合规
药品合规
 食品合规
食品合规
 食品接触材料/再生塑料
食品接触材料/再生塑料
 中国农药登记
中国农药登记
 境外农药登记
境外农药登记