原药等同性评估是非专利农药进入全球市场的一种快捷通道,评估的核心内容是对杂质的种类、含量以及危害进行评估。其中,通过毒理学评估进行杂质限度制定一直是农药等同性评估中的重点和难点,这个阶段需要采用(Q)SAR((Quantitative) Structure-Activity Relationship, 以下简称(Q)SAR)来进行杂质毒理学判断以及开展相关的毒理学试验。
为了助力企业通过等同性评估,瑞欧在2022年3月30日举办了线上讲座,围绕原药杂质毒理学等同判断以及(Q)SAR的应用难点进行了全面的剖析。
会议得到了大家的大力支持,会后诸多的提问也让我们感受到了大家的热情。因此,我们精选了大家普遍关注的几个问题进行解析,希望能帮助大家突破全球农药等同性评估中毒理学的技术壁垒。
QA合集大放送
Q1:(Q)SAR预测适用的化学物质范围是什么?
A1:(Q)SAR((Quantitative) Structure-Activity Relationship)的定义是描述分子结构和效应之间的定量/定性关系的模型或算法,主要通过物质的分子结构来计算或者推导物质的理化性质或者生物学效应。
因此,能采用(Q)SAR来进行预测的物质必须要有特定的化学结构,而像聚合物、UVCB之类没有特定结构的物质则不能使用(Q)SAR方法。除此之外,一些如核酸、多肽、蛋白质等生物大分子、金属元素以及盐类等无机物受限于当前(Q)SAR的训练集,也并不适用于(Q)SAR预测。
Q2:(Q)SAR适用于生物农药吗?
A2:结合(Q)SAR的定义,一般只要物质有特定的结构,就可以采用(Q)SAR的方法来进行预测。
生物农药包括了生物化学农药、微生物农药和植物源农药。因此,针对有特定结构的生物农药,比如阿维菌素、赤霉酸、昆虫信息素等这类结构明确的生物农药,可以采用(Q)SAR来进行毒性预测;而微生物农药(如枯草芽孢杆菌等)、生物大分子农药(多肽、蛋白)等则不能采用(Q)SAR来进行毒性的预测。
当前,瑞欧科技已帮助国内外企业成功完成了多种生物农药等同性评估中所需的(Q)SAR预测报告。
Q3:(Q)SAR和交叉参照(Read-Across)的不同是什么?
A3:(Q)SAR是描述分子结构和效应之间的定量/定性关系的模型或算法,主要依赖于集成在计算机中的模型进行预测,分为规则模型(Rule-based models)和统计模型(Statistic-based models)。
交叉参照是由一个或多个化合物(源物质)的终点信息预测另一个或多个具有相似特征的化合物(目标物质)的同一终点信息的一种非测试方法,通常依赖于人为的专家经验进行预测,分为类似物法(Analogue Approach)和分类法(Category Approach)。
但是在实际应用中,两种预测方法也会相互借鉴,如在(Q)SAR预测中通常也需要引入专家评估,以提高预测的准确性;在交叉参照中也通常会利用化学结构相似性算法,去自动寻找能与目标化合物进行交叉参照的类似物。
总体而言,采用这两种方法进行毒性预测时,(Q)SAR方法更依赖于模型本身,而交叉参照则更依赖于专家经验。
Q4:毒理学关注阈值(TTC)是否会根据不同的杂质而值不同?(毒理学关注阈值以下简称TTC)
A4:TTC的使用需要遵循一系列的原则,基于欧洲食品安全局(EFSA)指南中的TTC决策树,首先需要排除不适用于TTC的情况,若某个化合物被判定为具有内分泌干扰效应、生物富集性、关注序列(黄曲霉毒素类、N-亚硝基化合物,以及烷基-氧化偶氮基化合物)、放射性物质等时,则不适用于TTC方法。
再进一步基于目标化合物的毒理学数据、(Q)SAR预测结果或显著的结构特征来选择合适的TTC值,如对于识别到的潜在基因毒性物质,TTC值为0.15 μg/person/day;又如对于乙酰胆碱酶抑制剂等具有神经毒性的化合物(如有机磷),TTC值为18 μg/person/day。
除此之外的其他物质则可以根据Cramer分类方法,进一步分成三类,其中,Cramer I类物质的TTC值为1800 μg/person/day,Cramer II类物质的TTC值为540 μg/person/day,Cramer III类物质的TTC值为90 μg/person/day。
总体而言,TTC方法是一套比较科学的适用于杂质限度制定的工具,但TTC的使用需要遵循一系列原则,瑞欧科技建议TTC方法应在有毒理学背景人员的指导下来准确使用。
当前,TTC的概念自提出以来经过二十多年的应用也不断有一些新的发展,如进一步验证非基因致癌物的TTC值、特定作用途径的TTC值、以及探讨TTC方法本身的不确定性等,所以也需要关注这些更新后的方法来指导杂质的限度制定。
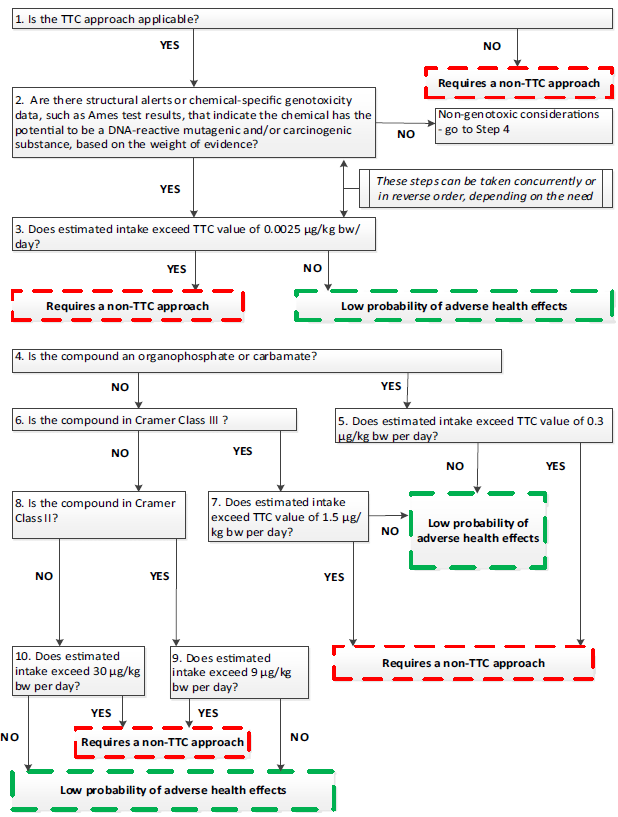 EFSA TTC决策树(来源于欧洲食品安全局(EFSA)指南)
EFSA TTC决策树(来源于欧洲食品安全局(EFSA)指南)
Q5:自建模型需要如何验证才能被官方接受?
A5:(Q)SAR 模型不论免费软件,商业软件还是自建模型,均建议遵循OECD于2014年发布的用于监管决策用途的QSAR模型五原则,分别是:
◆ A defined endpoint(一个确定的试验终点)
◆ An unambiguous algorithm(一个明确的算法)
◆ A defined domain of application(一个确定的应用域)
◆ Appropriate measure of goodness-of-fit, robustness and predictivity(具有适合测定拟合度、稳健性和预测性的方法)
◆ A mechanistic interpretation, if possible(如果可能,能够对机制进行解释)
当采用符合以上原则的模型进行(Q)SAR预测后,也建议进一步采用QMRF(QSAR Model Reporting Format)格式来进行模型说明报告的撰写,并在向官方评审机构提交(Q)SAR预测结果的同时附上QMRF等模型说明报告。
在自建模型应用于法规这一方面,瑞欧有着强劲的实力和优势,欢迎有相关需求的企业联系我们。
Q6:常用的 (Q)SAR软件有哪些,并应该如何选择?
A6:按照(Q)SAR软件的使用模式来划分可分为:免费软件与商业软件。
其中,常用的免费软件包括OECD QSAR Toolbox,VEGA等,常用的商业软件如Derek & Sarah Nexus等。商业软件较免费软件具有训练集大,模型解释性高和模型优化性好等诸多优势,因此我们更建议大家尝试使用商业软件来得到更为可靠的 (Q)SAR预测结果。
目前,瑞欧科技已经是权威(Q)SAR软件Derek & Sarah Nexus在农药领域唯一的中国授权服务商,并同时也具有其他众多商业软件、免费软件与化学信息学软件丰富的实际使用经验,能够帮助企业完成农药原药等同性评估中所需的高质量(Q)SAR报告。
Q7:(Q)SAR结果提示杂质具有致突变风险,是否会影响等同性评估?
A7:如果(Q)SAR预测结果显示杂质具有基因毒性,依据欧盟的要求,一般除了Ames试验外,还可能需要再补充一组体外哺乳动物细胞基因毒性试验(OECD TG 476等)和另一组体外哺乳细胞染色体损伤试验(OECD TG 473等),来证明杂质或含此杂质的原药不具有基因毒性。若只依据阳性的(Q)SAR预测结果,或在基因毒性试验中出现阳性结果,也可以依据TTC方法将杂质的含量控制在0.15 μg/person/day以下的暴露水平。
由于基因毒性物质的TTC值较低,在实际应用过程中企业普遍较难达到,在判断潜在基因毒性杂质是否会影响等同性评估时还存在多种方法,如基于杂质或其类似物已有的毒理学数据建立健康暴露限度(HBEL)来优化暴露评估。若能通过以上方法排除基因毒性/致突变杂质的风险,一般来说不会影响等同性评估。如果以上结果仍不能充分说明,也可以与官方协商后补充更为可靠的体内基因毒性试验数据。
Q8:中国农药评审中对(Q)SAR的接受度如何?
A8:根据目前中国农药登记法规的数据要求,是不允许使用(Q)SAR预测结果来作为相同原药或非相同原药等类型的登记数据,因此仍需要按照现有法规开展相应的毒理学试验数据。
但是得益于瑞欧科技在全球(Q)SAR应用方面的丰富经验,我们已帮助客户在新农药安全性评估、相关杂质限量制定以及相关代谢物识别等方面建立了一系列成功案例,从而能充分运用(Q)SAR方法来提供支持性数据,以加速产品的登记决策并尽可能避免潜在的登记风险。
相关阅读:
全球农药原药等同性评估中 (Q)SAR预测报告要求及难点解析
我们的服务:








 化学品合规
化学品合规
 化妆品合规
化妆品合规
 检验检测
检验检测
 安全管理智能化
安全管理智能化
 绿色低碳可持续
绿色低碳可持续
 药品合规
药品合规
 食品合规
食品合规
 食品接触材料/再生塑料
食品接触材料/再生塑料
 中国农药登记
中国农药登记
 境外农药登记
境外农药登记