本月17、18号两日国家食品药品监督管理局(国家食药监)接连发布第7、第10号公告,事关进口非特化妆品在浦东新区试点的备案管理。
自2013年11月国家食药监在第159号征求意见文中就提及进口非特的职能下放起,历时3年多,此次试点备案打开了职能下放的第一道口子。那对于企业和行业的影响有多深呢?
结论1:对于缩短产品上市周期利好,省去事前审批、制证时间
结论2:是否提高通过率还有待时间观察,取决于地方局的审查标准
结论3:责任人承担迄今最大责任,境内外企业都需要慎重考虑
结论4:此次调整暂不涉及动物测试
从新的管理公告可以看出,管理方式结合了现今的国产非特备案和进口非特殊用途化妆品行政许可申报流程及文件要求,甚至参考了其他国家的化妆品监管方式。
事实1:对象变化 --- 对象细分
现行行政许可申报面向所有首次进口化妆品,浦东新区备案管理细分了不同情况下的产品要求。
|
产品类型 |
解决方案 |
|
属于本工作程序适用范围的首次进口非特殊用途化妆品 |
可选择申报行政许可或备案 |
|
不属于本工作程序适用范围的首次进口非特殊用途化妆品 |
申报行政许可 |
|
已按本程序备案的产品,后续需要自其他口岸进口 |
注销备案产品信息,申报行政许可 |
|
已获首次进口非特殊用途化妆品行政许可,在许可有效期内自浦东口岸进口 |
无须按本程序重新办理备案相关手续 |
|
行政许可有效期结束,未申请延续或已注销行政许可 |
可按本程序办理备案 |
|
申请进口非特殊用途化妆品行政许可不予批准的产品 |
不得按本程序办理备案 |
需要企业重点关注的就是浦东新区备案不同于现行备案申报重合,在浦东新区备案后,需要自其他口岸进口的,应当注销备案产品信息,按照现行法规要求申报首次进口非特殊用途化妆品行政许可申报。
事实2:流程变化 --- 大体框架一致
流程大体思路框架与现行进口非特备案一致,主要分为用户注册、线上填报、线下提交和审查,审查环节差异较大,浦东新区备案流程如下:
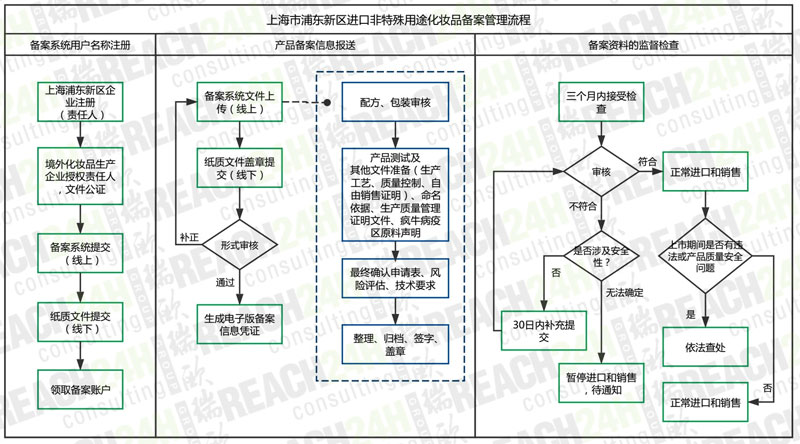
事实3:责任变化 --- 引进责任人概念
首次提及“责任人”概念,要求境外化妆品生产企业应当授权注册地在浦东新区的企业法人作为境内责任人,负责产品的进口和经营,并依法承担相应的产品质量安全责任。区别于在华申报责任单位的概念,责任人承担了更多的产品质量安全责任,同时责任人需要应对地方局的审查。这些职责义务要求责任人必须对产品本身及其安全性非常了解,具有一定的专业背景知识,且了解把控产品在境内的销售渠道。
事实4:文件变化 --- 稍作变更,未涉及动物测试
备案文件和现行《化妆品行政许可申报受理规定》856号文内要求基本一致,但新增一项境外生产企业生产质量管理的相关证明材料,并且未提及封样。以往申报时只有存在委托加工关系时,才需要提供被委托生产企业的GMP或生产质量管理文件。浦东新政新增此项标准,其实是完善了该项目的监管。另外企业都比较关注的动物测试要求是否会像国产非特一样调整,此次公告并未提及,因此仍按照现行法规要求实行毒理学检验。安全评估报告替代毒理学实验(大部分项目为动物测试)自2014年在国产非特备案中实施至今,相关指南、标准仍处于待定阶段,可能这也是此次未放开安全评估的原因之一。
事实5:审查变化 --- 事前转事后
现行进口非特化妆品属于事前审批制备案,不算真正意义上的“备案”,更偏向于注册。所有纸质文件必须交由国家食品药品监督管理局进行多项评审流程,从接收到制证约三个月时间,如若有要求补充文件,则还会延长审批时间。此次浦东新区备案管理方式真正落实“备案”监管,在国家提倡简政放权的大环境下,监管主体由国家局转变为上海食药监局,企业进行线上和线下提交后,地方局仅针对产品范畴、文件完整性和格式正确性进行审核,不涉及实质内容审查。备案成功后,企业即可进口和销售产品。地方局会在三个月内进行线上或线下具体文件审查,如有问题,再要求企业补充。
此次调整主要是在备案方式上的变更,缩短了申报周期,对于境外的口红等更新速度较快的、急需缩短合规周期的彩妆品牌来说,是利好消息。然而新政实施不确定因素较多,企业仍需谨慎判断自身情况再做选择,但审查的关键要素还是产品的安全性。
如果您有任何相关,问题,欢迎联系我们:
联系人:陈女士
电话: 0571-87007508
Email: customer@reach24h.com
参考链接:
《关于在上海市浦东新区试点实施进口非特殊用途化妆品备案管理有关事宜的公告(2017年第7号)》
《总局关于发布上海市浦东新区进口非特殊用途化妆品备案管理工作程序(暂行)的公告(2017年第10号)》






 化学品合规
化学品合规
 化妆品合规
化妆品合规
 检验检测
检验检测
 安全管理智能化
安全管理智能化
 绿色低碳可持续
绿色低碳可持续
 药品合规
药品合规
 食品合规
食品合规
 食品接触材料/再生塑料
食品接触材料/再生塑料
 中国农药登记
中国农药登记
 境外农药登记
境外农药登记