2019年5月27日,国家药品监督管理局发布了对《非特殊用途化妆品备案管理办法》的征求意见稿,非特化妆品终于有了统一的备案管理标准。

2019年5月29日,国家药品监督管理局悄无声息地官宣了特殊用途化妆品延续承诺制审批的有关事宜。迎来了国产和进口特殊用途化妆品延续的改革。
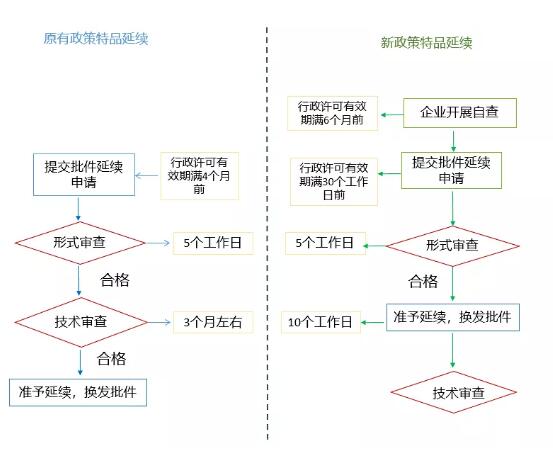
针对特品延续申请的新政策到底有哪些变化呢 1.15个工作日可拿到延续批件 新政策明确了申请人如果通过了形式审查,最快15个工作日即可获得批件。这一延续申请加速令化妆品企业激动不已。形式审查主要包括申请资料是否完整、申请资料是否符合规定形式要求、产品自查是否全面等内容。 如果企业有以下情况,不予受理: 2.事后技术审查 考虑到需要延续的产品已经经过了4年的市场检验,还能在市场上流通,说明安全性是没问题的。 因此,针对批件有效期届满需要延续的特殊用途化妆品,国家药品监督管理局不再进行事前的技术审查工作,转为由申请人在产品批件届满前6个月起,对产品开展全面自查。经申请人自查评估符合现行法规要求的,直接准予延续。产品的安全性通过事后组织专家进行技术审查。 同时,国家药品监督管理局和省级药品监督管理部门配合开展对延续产品的监督检查。虽然调整为事后进行技术审查,但是安全性要求没有降低。发现延续产品违反相关法律法规、标准规范规定,或产品生产情况与延续申请资料不一致的,依法立案查处;需要撤销行政许可的,要及时上报国家药品监督管理局。 3.技术审查关注点转移 根据原有政策和新政策要求提交的资料对比(如表1),我们可以看出,新政要求提交的自查承诺报告更注重市场方面的监管,由于延续产品已经做过一次严格的技术审查和安全性评估,也历经了市场的检验。本次新政策将审查重点转移到市场规范上面。但是,值得注意的是,对于在上一个批件有效期内未生产或进口销售的产品,申请人还应当对产品进行重新检验和安全风险评估,并提交行政许可检验报告和安全性风险评估资料。 原有政策和新政策延续申请资料对比 虽然说关注点转向市场规范方面,但是如果延续产品有以下问题,将会被撤销产品批件: 4.放宽延续申请日期 原有政策中,化妆品行政许可批件(备案凭证)期满4个月前提出延续申请,现在放宽到了30个工作日。也就是说,需要申请行政许可延续的产品,申请人应该在产品批件届满前6个月起对产品进行全面自查,并在批件有效期届满30个工作日前提交批件延续申请。 举例:产品批件有效期为2018年4月1日至2022年3月31日。 那么企业开展产品自查工作在2021年9月31日以后;批件延续申请应当于2022年2月18日前(有效期届满30个工作日前)提交。 新政策自2019年6月30日起实施可能有些企业在此《公告》发出前已经提交了批件延续申请是否需要按照新的《公告》重新进行批件延续申请呢? 瑞欧提醒: 国产和进口特殊用途化妆品延续申请事宜经过近半年的征求意见,终于确定下来。这对于化妆品企业来说是一重大利好消息,企业可以短时间内拿到特品延续批件。预计接下来还会有一系列新的法规出台,企业需要持续关注化妆品法规新动态,最大程度减少合规风险和成本。







 化学品合规
化学品合规
 化妆品合规
化妆品合规
 检验检测
检验检测
 安全管理智能化
安全管理智能化
 绿色低碳可持续
绿色低碳可持续
 药品合规
药品合规
 食品合规
食品合规
 食品接触材料/再生塑料
食品接触材料/再生塑料
 中国农药登记
中国农药登记
 境外农药登记
境外农药登记