化妆品原料的毒理安全资料在完整版化妆品安全评估报告中至关重要。在《助力完整版化妆品安全评估——国际权威机构清单与介绍》中,我们为大家汇总介绍了原料安全评估证据类型主要来源的国际权威机构。
对于没有CIR、SCCS等国际权威化妆品原料评估机构评估结论的原料,原料的系统毒性数据则在完整版安评以及化妆品产品顺利上市销售中尤为重要。
除大分子聚合物外,国内外监管部门和权威机构发布的安全食用清单/公告等,是企业豁免系统毒性的有力证据。而作为在北美及世界各地都有着极高认可度的GRAS,是《化妆品安全评估技术导则》中认可的证据类型之一。
了解GRAS认证,有助于在化妆品安全评估中正确、合理地应用该证据类型。下面,瑞欧科技将为您介绍GRAS认证的相关内容:
GRAS的定义
GRAS的英文全称是“Generally Recognized As Safe” (公认安全)。GRAS是美国食品药品监督管理局(FDA)对食品原料安全性的一种评估机制。
FDA对GRAS并没有直接和单独的定义。GRAS的法规定义为:无需经过FDA的上市前审查和批准,由专家普遍认为在预期使用条件下是安全的食品物质。
GRAS背景介绍
这张图是FDA列出的关于GRAS物质认证的发展历程,我们将选取具有节点意义的事件,为大家介绍GRAS的背景。
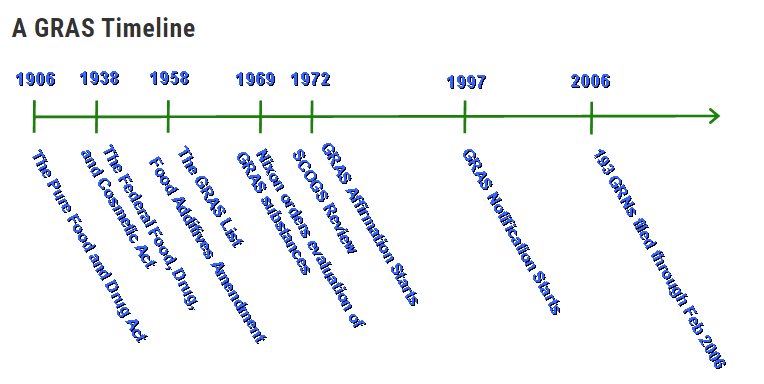
1958年:GRAS清单
1958年,美国出台的《食品添加剂修正案》规定,任何食品添加剂都需要先经过FDA的上市前批准才可以使用;
而经过长期的使用认为没有安全性问题的物质(1958年之前食品中使用的物质)以及经过“具有充分科学背景的专家”进行严格的安全审查并批准后的物质则豁免在外,即GRAS物质。
FDA在1958年12月9日公布了GRAS清单。但FDA并没有对这些GRAS物质的信息进行系统性评估。
1969年:GRAS评估
1969年10月30日,基于1969年的白宫指令,FDA委托其他机构成立了GRAS物质选择委员会 (SCOGS, Select Committee on GRAS Substances),负责对GRAS物质进行科学评估。
后续,FDA在《联邦公报》上向公众提供了SCOGS的初步报告,且审查了SCOGS报告并建立了机构内部使用的GRAS状态审查程序规则
在FDA官网数据库上,可以查到1972年至1980年发布的115份SCOGS报告中关于370多种GRAS物质安全性的评估意见和结论。
具体可查看:FDA官网数据库
此外,FDA提出了GRAS确认申请程序(the GRAS affirmation petition process),也就是个人可以请求FDA审查未被视为该机构GRAS审查范围的物质的GRAS状态。
1997年:GRAS通告
1997年,为了有效利用资源,FDA又发布了一项拟议规则(62 FR 18938; April 17, 1997),用通告程序取代GRAS确认申请程序,即现行的GRAS通告(GRAS notice)。
具体可查看:GRAS通告查询网址
GRAS认证类型
当前,美国通过2种途径来监管GRAS,即提交至FDA的GRAS通告(FDA GRAS notice)和自我确认GRAS (Self-affirmed GRAS)。
GRAS通告程序和自我确认的GRAS程序有各自的优缺点。

GRAS认证实例
FDA GRAS通告:嘉必优DHA藻油
嘉必优DHA藻油获得的GRAS认证程序是GRAS通告。
即由美国FDA认可的GRAS专家小组集体签署认证嘉必优生物技术(武汉)股份有限公司生产的 DHA 藻油是安全的,可以在FDA官网上查证(GRAS Notice (GRN) No.934, Notifier: CABIO Biotech (Wuhan) Co., Ltd.)。

自我确认GRAS:基因港NMN(烟酰胺单核苷酸)
基因港(香港)生物科技有限公司出具的 NMN 的GRAS证书显示为通过自我确认的方式。
即邀请行业专家按照FDA标准认证的,未提交到FDA,因此无法在FDA官网上查证。

图源:http://www.nmnchina.com/infoDetail/37.html
GRAS通告意义
从美国的食品法律意义上说,申请FDA的GRAS通告程序是自愿行为。
FDA力荐企业按照GRAS通告程序提交相关材料。从生产企业的实际情况和市场要求的角度,生产企业也希望主动向FDA通告。
虽然FDA对一份GRAS通告的回复并不意味着批准或许可,但企业更愿意在入市之前得到FDA对GRAS通告的评估,确保随后不会产生安全或法规的问题,也有利于市场的开拓和销售。
FDA GRAS通告程序
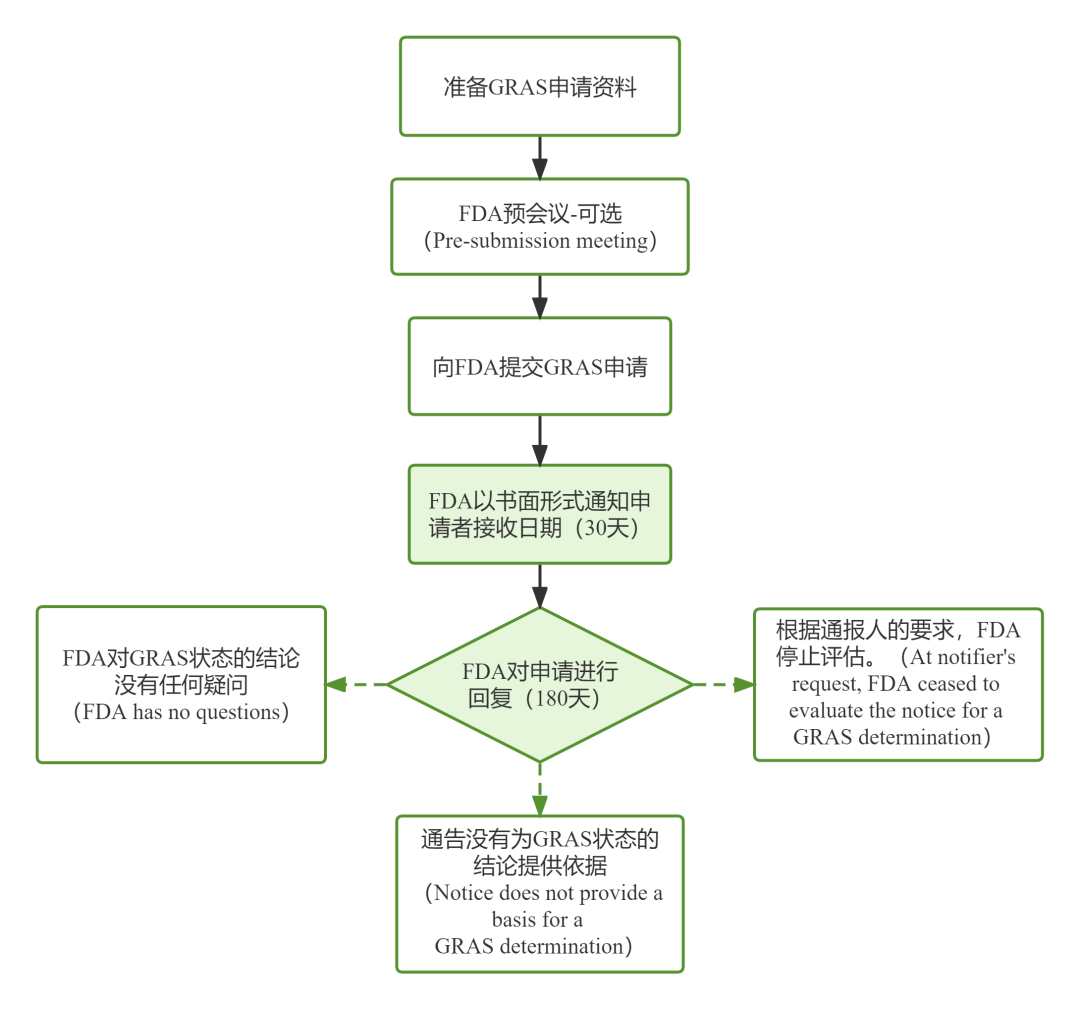
FDA GRAS通告所需资料清单

GRAS认证在化妆品安全评估中应用
限制条件的符合
在特定条件下使用安全是判定GRAS的一个关键要素。GRAS物质在化妆品中使用时,也需考虑相关限制条件,比如在食品中使用是否有限量。
局部毒性的评估
由于食品成分仅涉及经口暴露途径,即仅有系统毒性评估结论,而作为化妆品原料使用时还涉及皮肤暴露途径。
因此,在采用GRAS评估结论作为证据时,还需要结合化妆品产品或原料毒理学测试结果或人体临床测试结果,对化妆品产品刺激性等局部毒性进行评估。
相关阅读:
美国化妆品工厂注册和产品列名提交方式汇总(SPL Xforms编写工具公布)








 化学品合规
化学品合规
 化妆品合规
化妆品合规
 检验检测
检验检测
 安全管理智能化
安全管理智能化
 绿色低碳可持续
绿色低碳可持续
 药品合规
药品合规
 食品合规
食品合规
 食品接触材料/再生塑料
食品接触材料/再生塑料
 中国农药登记
中国农药登记
 境外农药登记
境外农药登记