2024年3月19日,为规范开展化妆品安全评估工作,中国食品药品检定研究院发布关于征求《毒理学关注阈值(TTC)方法应用技术指南(征求意见稿)》等意见的通知。
公开征求意见截至2024年4月7日,相关利益方可将反馈意见发送电子邮件至 hzpbwh@nifdc.org.cn。
《毒理学关注阈值(TTC)方法应用技术指南(征求意见稿)》及其起草说明全文如下:
《毒理学关注阈值(TTC)方法应用技术指南(征求意见稿)》
1. 概述
毒理学关注阈值(Threshold of Toxicological Concern,TTC)方法是基于化学物质的毒性效应主要与其结构相关这一基本假设。关键是确定是否适用于TTC并进行结构归类,且不能低估暴露量。
本指南介绍了TTC在化妆品安全评估中的应用,明确了TTC方法的适用范围、术语和释义、物质分类、评估程序以及混合物的使用要求。
2. 适用范围
适用于化学结构明确,且不包含严重致突变警告结构,含量较低且缺乏系统毒理学研究数据的化妆品原料或风险物质。
以下原料或风险物质不适用于本指南,包括金属或金属化合物、强致癌物(如黄曲霉毒素、亚硝基化合物和联苯胺类等)、蛋白质、类固醇、高分子质量的物质、有很强生物蓄积性物质以及放射性化学物质等;具有防腐、防晒、着色、染发、祛斑美白、防脱发、祛痘、抗皱(物理性抗皱除外)、去屑、除臭功能以及具有较高生物活性的原料;具有吸入风险的原料、纳米原料和无机物等。
3. 术语和释义
3.1 毒理学关注阈值(Threshold of Toxicological Concern,TTC)
在该暴露水平下,预计不存在危害人类健康的风险。
3.2 全身暴露量(Systemic Exposure Dosage,SED)
通过各种暴露途径进入体循环的待评估物质的预计量,通常以μg/kg bw/day表示。
3.3 潜在DNA反应性致突变物/致癌物(Potential DNA-Reactive Mutagens/Carcinogens)
直接作用于DNA,可能引起DNA损伤导致复制错误或可能诱导细胞癌变的物质。
3.4 Cramer类别(Cramer Class)
在TTC评估中,根据化学物质的分子结构和潜在毒性将化学物质分为三类,分别为Cramer I类、Cramer II类和Cramer III类。
4. 物质分类
根据待评估物质是否具有遗传毒性,分为潜在或非潜在DNA反应性致突变物/致癌物。
4.1 潜在DNA反应性致突变物/致癌物的TTC阈值
潜在DNA反应性致突变物/致癌物的TTC为0.0025µg/kg/day。
4.2 非潜在DNA反应性致突变物/致癌物的TTC阈值
根据待评估物质化学结构和代谢物安全性相关的问题,非潜在DNA反应性致突变物/致癌物分为Cramer I类 、Cramer II类和Cramer III类物质。
Cramer I类:结构简单易代谢,经口毒性低的物质。包括:支链无环脂肪烃、普通碳水化合物、普通萜类、不具有特定官能团脂肪族化合物的磺酸盐或氨基磺酸盐等。这类物质的TTC为46µg/kg/day。
Cramer III类:具有不能初步假定安全性高、甚至可能显示出有明显的毒性或含有反应性官能团的化学结构的物质,包括:含脂肪族仲胺、氰基、亚硝基、重氮、三氮烯或季铵氮原子的化合物;含除碳、 氢、氧、氮或二价硫以外元素且这些元素非以简单阴阳离子形式存在的物质;某些苯衍生物;某些杂环物质;含有三种以上特定官能团且包含游离不饱和杂原子的脂肪族物质等。这类物质的TTC为2.3µg/kg/day。
Cramer II 类:介于其中的物质。即具有比Cramer I类物质毒性强、但不像Cramer III类物质那样具有明显毒性结构特征的物质。包括除醇、醛、侧链酮、酸、酯之外没有其他官能团的物质;含简单取代基的单碳环且无环缩醛或缩酮的化合物,单环烷酮或带有或不带有环酮的双环物质等。这类物质的TTC为2.3µg/kg/day。
5. 评估程序
依次按以下步骤展开评估,评估程序流程图见附录1.
5.1 判断待评估物质是否符合TTC的适用范围
判断待评估物质是否符合TTC方法的使用条件。如果符合,可使用TTC法进行评估该物质的安全性;如果不符合,需要按照《化妆品安全评估技术导则(2021年版)》(以下简称《导则》)要求进行安全评估。
5.2 计算全身暴露量(SED)
按照《导则》中4.3规定的方法开展暴露评估,计算待评估物质的SED。
5.3 待评估物质是否为潜在DNA反应性致突变物/致癌物
开展至少两项不同遗传毒性终点的试验(至少包括一项基因突变试验和一项染色体畸变试验)。若待评估物质的一项或多项试验结果为阳性,不能排除遗传毒性时,则判定该物质为潜在DNA反应性致突变物/致癌物;当不同遗传毒性终点的试验结果均为阴性,判定该物质为非潜在DNA反应性致突变物/致癌物。
5.4 待评估物质是潜在DNA反应性致突变物/致癌物
如SED ≥ 0.0025µg/kg/day,则认为其引起癌症的风险性较高。
如SED < 0.0025µg/kg/day,则认为该物质引起癌症的风险性较低,可以安全使用。
5.5 待评估物质是非潜在DNA反应性致突变物/致癌物
根据物质分类判定原则判断Cramer类别,并与相应的阈值进行比对。如根据原则判断待评估物质属于Cramer I类物质,SED ≥ 46 µg/kg/day,该物质需要按照《导则》进一步开展安全评估;SED < 46 µg/kg/day,则待评估物质在当前使用条件下的风险在可接受范围之内。
6. 混合物
对于混合物如植物提取物,需确定待评估物质是否为潜在DNA反应性致突变物/致癌物,尽可能多的识别出具体成分,除生产过程中添加的必要溶剂或稳定剂、防腐剂、抗氧化剂等外,需确定成分含量不低于80%。对于已知成分,分别采用适宜的评估方法进行安全评估,以确保使用安全,若含有结构类似的成分,应进行剂量叠加评估;对于未知成分,若无法确定Cramer类别,其整体的Cramer类别按TTC最低的一类计,即Cramer III类。
附录1
TTC应用于化妆品安全评估流程图
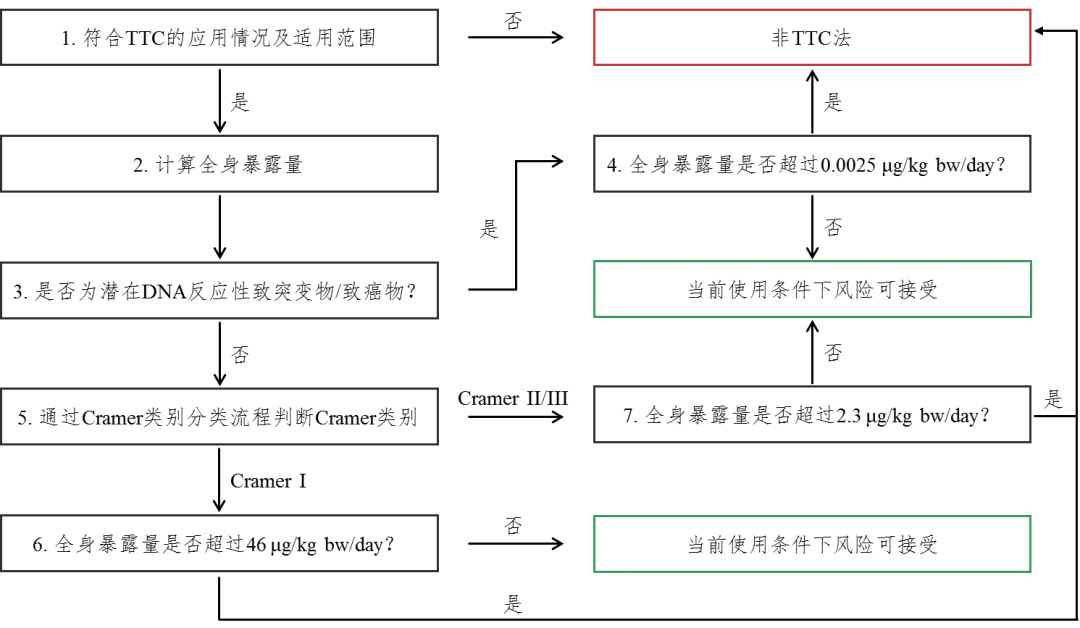
图1 TTC应用于化妆品安全评估流程图
附录2
TTC法在化妆品原料安全评估中应用示例(化学物质)
注:实例所用数据非真实数据,仅供方法参考。
1. 待评估物质信息
中文名称:己基癸醇,《已使用化妆品原料目录(2021年版)》中3202号
INCI名称/英文名称:HEXYLDECANOL
CAS号:2425-77-6
化妆品中浓度及使用产品类别:0.0001%,身体乳
分子式:C16H34O
结构式:
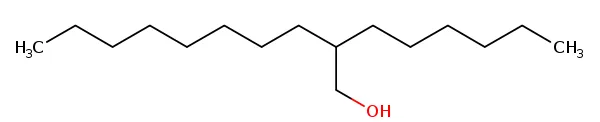
图2 己基癸醇的化学结构图
2. 待评估物质基本理化特性
物理状态:无色液体
熔点/凝固点:-69℃
相对密度:0.8369,20℃
沸点:300℃
蒸汽压:0.004 mbar,38℃
溶解度:<1 mg/L
脂水分配系数:6.66
闪点:159℃
燃点:238℃
粘度:41.1 mPa s,20℃
3. 待评估物质局部毒理学信息
急性毒性:根据供应商测试,该原料在大鼠急性经口毒性试验中,LD0>2000 mg/kg bw且无动物死亡,表明该原料急性经口毒性为低毒性;
皮肤刺激性:在家兔多次皮肤刺激试验中,采用0.1%的该原料进行试验,显示该成分为无刺激性;
皮肤光毒性和光变态反应:采用0.1%的该原料进行试验,未见皮肤光毒性和光变态反应;
皮肤致敏性:根据供应商测试,局部封闭涂皮(Buehler Test, BT)试验中,采用0.1%的该原料进行诱导接触和激发接触,未见皮肤变态反应;
遗传毒性:细菌回复突变试验和体外染色体畸变试验结果显示,己基癸醇未引起基因突变和染色剂畸变;
其他系统毒性:未收集到该成分系统毒性信息。
4. 评估步骤
4.1 判断待评估物质是否符合TTC使用范围
已知待评估物质的化学结构,在身体乳中的含量较低,主要暴露途径为经皮,暴露量可计算,缺乏系统毒理学数据,且不属于需排除的情形,故可用TTC法进行评估。
4.2 计算全身暴露量
用以下公式计算:
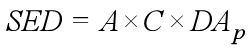
式中,A为以单位体重计的化妆品每天使用量[mg/(kg bw·d)],可参考《The SCCS's Notes of Guidance for the Testing of Cosmetic Substances and Their Safety Evaluation-12th Revision》;C为该化合物在产品中的浓度(%);DAp为经皮吸收率(%),默认的经皮吸收率为100%。
因此,SED = 7.82×106×0.0001×1×1/(60×100) = 0.13µg/kg/day
4.3 待评估物质是否为潜在DNA反应性致突变物/致癌物
该物质为非潜在DNA反应性致突变物/致癌物。
4.4 结论
根据物质分类原则或使用分类软件(如欧洲化学品管理局开发的Toxtree、经济合作与发展组织开发的QSAR Toolbox等)并经确认,己基癸醇属于Cramer I类物质。身体乳中浓度为0.0001%的己基癸醇的全身暴露量为0.13µg/kg/day,小于Cramer I类物质的毒理学关注阈值46 µg/kg/day。
综上所述,对己基癸醇的局部毒性、遗传毒性和TTC评价结果等信息进行综合评价,认为身体乳中使用浓度为0.0001%的己基癸醇时,在正常、合理的及可预见的使用条件下,不会对人体健康产生危害。
5. 参考文献
略。
附录3
TTC法在化妆品原料安全评估中应用示例(植物提取物)
注:实例所用数据非真实数据,仅供方法参考。
1. 待评估物质信息
中文名称:某植物提取物,《已使用化妆品原料目录(2021年版)》中※号
IINCI名称/英文名称:※ EXTRACT
化妆品中的浓度及使用产品类别:0.1%,面霜
2. 待评估物质成分分析
该物质为植物提取物,通过文献检索或成分分析,含有未知成分8.16%,具体见表1(注:非真实数据,仅供方法参考)。
表1 某植物提取物成分及含量表
成分 | 含量(%) |
纤维素 | 25.459 |
…… | …… |
水 | 4.95 |
…… | …… |
未知成分 | 8.16 |
3. 待评估物质毒理学信息
急性毒性:根据供应商测试,该原料在大鼠急性经口毒性试验中,LD50>2000 mg/kg bw且无动物死亡,表明该原料急性经口毒性为低毒性;
皮肤刺激性:根据供应商测试,在家兔多次皮肤刺激试验中,采用2.0 %的该原料进行试验,显示该成分为无刺激性;
皮肤光毒性和光变态反应:根据文献资料,采用2.0%的该原料进行试验,未见皮肤光毒性和光变态反应;
皮肤致敏性:供应商数据显示,局部封闭涂皮(Buehler Test, BT)试验中,采用2.0%的该原料进行涂皮和激发接触,未见皮肤变态反应;
遗传毒性:细菌回复突变试验和体外染色体畸变试验结果显示,该原料未引起基因突变和染色剂畸变;
其他系统毒性:未收集到该成分系统毒性数据。
4. 评估步骤
4.1 判断待评估物质是否符合TTC使用范围
待评估物质的暴露量可计算,缺乏系统毒理学数据,且不属于需排除的情形,故可用TTC法进行评估。
4.2 待评估物质是否为潜在DNA反应性致突变物/致癌物
该植物提取物为非潜在DNA反应性致突变物/致癌物。
4.3 识别出成分是否符合方法应用要求
识别出成分为91.84%,超过80%,符合混合物的TTC使用技术要求。
4.4 已知成分的风险评估
1)纤维素
纤维素,INCI名称CELLULOSE,属于一般认为安全物质(GRAS)。CIR评估结果显示,使用浓度为0.002%~99%时,纤维素在驻留类化妆品中的实际使用都是安全的。该植物提取物中含有25.459%的纤维素,产品中含量为0. 25%。纤维素在本产品中的应用风险在可接受范围之内。
2)其他成分,分别采用适宜的评估方法进行了安全评估,以确保使用安全,若含有结构类似的成分,应进行剂量叠加进行评估参照。
具体各成分评估内容略。
4.5 未知成分的风险评估
该植物提取物中未知成分的含量为8.16%,未测试遗传毒性,保守起见,将未知成分当作整体计算全身暴露量,与TTC最低的 Cramer III类别对比。未知成分在产品中的暴露量为:SED = 1.54×106×0.001×0.0816×1×1/60 = 2.09µg/kg/day,低于2.3µg/kg/day,故无系统毒性风险。未知成分在本产品中的应用风险在可接受范围之内。
5. 综合评价
基于权重证据,包括该植物提取物的毒理学数据,已知成分的MoS值,使用历史,CIR评估报告,证明了在当前使用条件下,已知成分的风险可接受;该植物提取物中未知成分的全身暴露量SED低于Cramer III类别的阈值2.3µg/kg/day,证明在当前使用条件下,未知成分的风险可接受。
综上所述,对该植物提取物的局部毒性、遗传毒性和TTC等信息进行综合评价,认为该植物提取物在面霜中使用浓度为0.1%时,在正常、合理的及可预见的使用条件下,不会对人体健康产生危害。
6. 参考文献
略。
《毒理学关注阈值(TTC)方法应用技术指南(征求意见稿)》起草说明
为引导化妆品行业提升化妆品安全评估能力和水平,规范开展化妆品安全评估工作,推进化妆品安全评估制度有序实施,依据《化妆品监督管理条例》(以下简称《条例》)《化妆品注册备案管理办法》《化妆品安全评估技术导则(2021年版)》(以下简称《导则》)等相关法律法规和规范性文件要求,国家药监局化妆品监管司组织中国食品药品检定研究院(以下称中检院)起草了《毒理学关注阈值(TTC)方法应用技术指南(征求意见稿)》(以下简称《指南(征求意见稿)》)。现将起草的有关情况说明如下:
一、必要性
化妆品安全评估是产品安全评价的有效手段,能有效地反映出化妆品的潜在风险。目前,美国、欧盟、日本等发达国家或地区,均运用安全评估手段进行化妆品安全性评价。为规范指导化妆品安全评估工作,国家药监局发布了《导则》的公告(2021年第51号),提供了化妆品产品安全评估报告的完整版和简化版示例,并提出在2024年5月1日前,化妆品注册人、备案人可以按照《导则》相关要求,提交简化版产品安全评估报告。
随着过渡期即将结束,行业反馈实施完整版安全评估压力较大,存在安评能力不足、部分原料安全信息尤其是植物提取物的系统毒性信息不足以及国际化妆品动物禁令等困难。为推进化妆品安全评估制度平稳实施,提升行业安全评估相关技术的应用能力,需要制订发布更为全面、详实的安全评估技术应用指南,细化安全评估技术要求,明确方法的适用范围和评估程序,并给出应用示例,指导企业提升化妆品安全评估能力和水平。
二、制定原则
(一)依法依规原则。《指南(征求意见稿)》遵循依法依规原则,贯彻《条例》精神,落实《导则》和《公告》等相关文件要求,对相关技术问题和技术原则予以明确。
(二)科学可行原则性。在充分参考国内外化妆品、化学品和食品相关标准法规的基础上,如欧盟消费者委员会《化妆品成分测试及其安全性评估指南》、欧盟化学品管理局(ECHA)、欧盟食品安全局(EFSA)和美国环境保护局(US EPA)等相关指南文件,充分结合我国化妆品行业评估能力现状,制订《指南(征求意见稿)》。
(三)公开透明原则。起草过程中,坚持“公开透明、广泛参与”原则,多次组织监管部门、技术专家、行业协会和企业召开专题会议进行专题研究,同时根据意见反馈情况及时修改完善。
三、主要内容
本《指南(征求意见稿)》共六部分,分别对TTC技术进行概述、明确其适用范围、术语和释义、物质分类、评估程序以及混合物应用技术要求。同时,附录中提供了评估流程图、化学物质和植物提取物的应用示例。
四、需说明的问题
(一)关于适用范围。本《指南(征求意见稿)》在参考国际相关标准的基础上,结合我国化妆品行业特点,基于风险管理原则,结合原料功能,对可能相对较高风险的几类原料以及国际共识不适用的物质,明确提出不适合应用TTC方法。
(二)关于动态更新。相对于化学物质,应用TTC技术对混合物如植物提取物进行风险评估的研究报道较少。随着工作的逐步开展,科学技术的进步和人们认知水平的提高,《指南》将持续更新相关技术要求,提高风险特征鉴定的水平和预见性,使风险管理处于合理可控的水平。
相关阅读:







 化学品合规
化学品合规
 化妆品合规
化妆品合规
 检验检测
检验检测
 安全管理智能化
安全管理智能化
 绿色低碳可持续
绿色低碳可持续
 药品合规
药品合规
 食品合规
食品合规
 食品接触材料/再生塑料
食品接触材料/再生塑料
 中国农药登记
中国农药登记
 境外农药登记
境外农药登记