2024年3月29日,为确保化妆品安全评估工作平稳推进,中国食品药品检定研究院发布关于对《化妆品安全评估资料提交指南(征求意见稿)》《化妆品风险物质识别与评估技术指导原则(征求意见稿)》等2项技术文件对外公开征求意见的通知。
公开征求意见截至2024年4月8日,相关利益方可将反馈意见发送电子邮件至 hzppjzx@nifdc.org.cn。
《化妆品安全评估资料提交指南(征求意见稿)》及其起草说明全文如下:
《化妆品安全评估资料提交指南(征求意见稿)》
一、概述
根据《化妆品监督管理条例》规定,化妆品注册人/备案人在申请注册或进行备案前应当自行或委托专业机构开展安全评估,并在申请注册或进行备案时提交安全评估资料。按照国家药监局优化化妆品安全评估管理工作相关要求,为推进化妆品安全评估制度有序实施,充分落实企业的主体责任,基于风险管理原则,对化妆品安全评估资料提交的情形进行分类;并制定化妆品安全评估报告自查要点,指导企业开展产品安全评估工作,提升产品安全评估报告规范性、完整性、科学性。
根据《化妆品监督管理条例》《化妆品注册备案管理办法》《化妆品安全评估技术导则(2021年版)》及相关法律法规、国家标准和技术规范的要求制定《化妆品安全评估资料提交指南(征求意见稿)》(以下简称《提交指南(征求意见稿)》。
《提交指南(征求意见稿)》是在现行法规、标准以及当前认知水平下考虑行业实际情况制定,随着法规和标准的不断完善以及科学技术和行业的不断发展,相关内容将适时进行调整。
二、适用范围
《提交指南(征求意见稿)》适用于化妆品注册人/备案人在申请注册或进行备案时提交安全评估资料内容的情形判定,以及化妆品企业质量安全责任人或授权的安全评估责任人开展安全评估报告的自查。
三、化妆品分类
参照《化妆品分类规则和分类目录》的分类规则,在化妆品的功效宣称、作用部位、产品剂型、使用人群的不同维度分类的基础上,综合考虑不同类型产品的风险,增加是否使用监测期新原料或纳米原料、是否必须配合仪器或者工具使用、pH范围等分类维度,将化妆品按照风险程度分为三类。
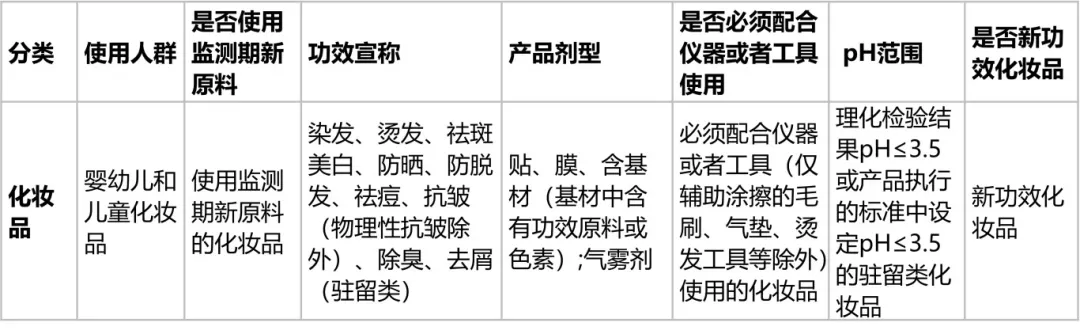
(一)第一类化妆品
(1)使用人群为婴幼儿和儿童化妆品;
(2)使用安全监测期新原料的化妆品;
(3)功效宣称为染发、烫发、祛斑美白、防晒、防脱发、祛痘、抗皱(物理性抗皱除外)、除臭、去屑(驻留类)的化妆品;
(4)产品剂型为贴、膜、含基材(基材中含有功效原料或色素)或者气雾剂的化妆品;
(5)必须配合仪器或者工具(仅辅助涂擦的毛刷、气垫、烫发工具等除外)使用的化妆品;
(6)理化检验结果pH≤3.5或产品执行的标准中设定pH≤3.5的驻留类化妆品;
(7)新功效化妆品。
第一类化妆品的具体情形见表1。
表1 第一类化妆品
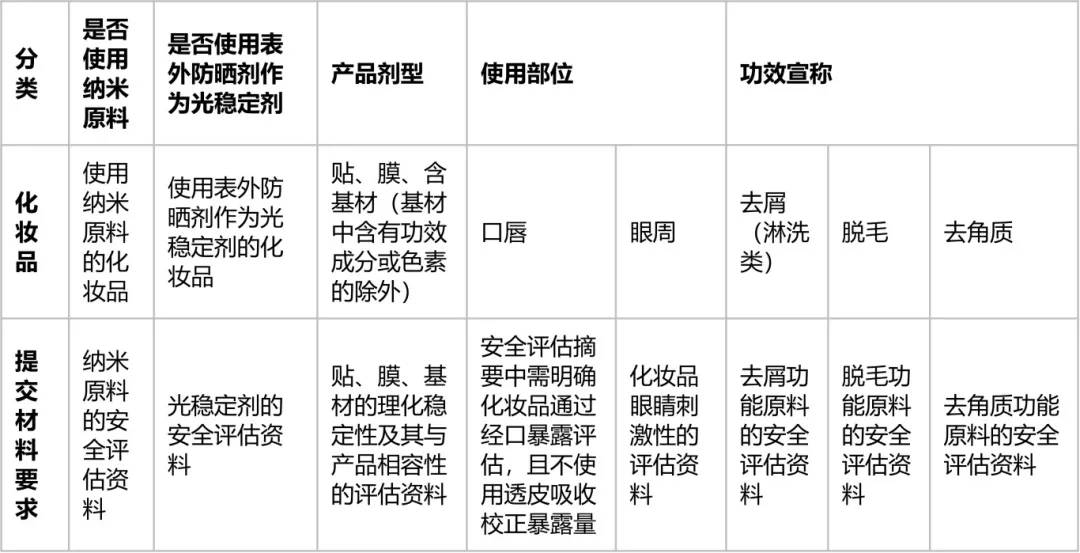
(二)第二类化妆品
(1)使用纳米原料的化妆品;
(2)非防晒类化妆品中使用表外防晒剂作为光稳定剂的化妆品;
(3)产品剂型为贴、膜、含基材(基材中含有功效原料或色素的除外)的化妆品;
(4)使用部位为口唇或眼周的化妆品;
(5)功效宣称为去屑(淋洗类)、脱毛、去角质的化妆品。
第二类化妆品重点关注产品中较高风险的原料或者基材等的安全评估,需要提交相应的评估资料(见表2)。
表2 第二类化妆品
(三)第三类化妆品
除第一类和第二类之外的其他普通化妆品。
四、资料提交情形分类
为充分落实企业是化妆品质量安全主体责任,化妆品注册人/备案人在申请注册或进行备案前,应当按照《化妆品安全评估技术导则(2021年版)》及相关技术指导文件原则和要求自行或委托专业机构开展安全评估,形成安全评估报告;可按照《化妆品安全评估报告自查要点》(附件1)相关原则和要求对安全评估报告进行自查,形成安全评估结论(附件2)。
基于风险管理原则,结合产品情况、化妆品注册人/备案人质量管理体系能力建设情况,同时结合注册人/备案人的备案技术核查、监督抽检和不良反应监测相关情况,明确化妆品安全评估资料的提交情形。
(一)提交安全评估报告
存在以下情形的应提交安全评估报告:
1. 第一类化妆品,应提交安全评估报告。
2.化妆品备案人出现《化妆品监督管理条例》第五十九条、第六十条违法情形被依法行政处罚的,自行政处罚决定作出之日起一年内,其进行备案的化妆品应提交安全评估报告。
(二)附条件存档备查
第二类化妆品,生产企业已取得所在国(地区)政府主管部门出具的生产质量管理体系相关资质认证并有效实施,且能够满足相关评估材料的要求(表2),在备案时需要提交化妆品安全评估结论,安全评估报告可以存档备查。
(三)存档备查
第三类化妆品在备案时,需要提交化妆品安全评估结论,安全评估报告可以存档备查。
(四)补充提交安全评估报告
第二类、第三类化妆品,因质量安全原因依法暂停生产、进口销售;或者监督抽检出现与质量安全相关的不合格项;或者出现较大社会影响的不良反应时,备案人应于三十个工作日内,结合对缺陷问题的自查分析情况,补充提交相关涉及产品的安全评估报告。
附件:
1.化妆品安全评估报告自查要点
2.化妆品安全评估结论
附件1 化妆品安全评估报告自查要点
为规范化妆品安全评估报告的编制,保障化妆品企业对化妆品安全评估报告的自查工作有序开展,根据《化妆品监督管理条例》《化妆品注册备案管理办法》《化妆品安全评估技术导则(2021年版)》及相关法律法规、国家标准和技术规范的要求制定《化妆品安全评估报告自查要点》(以下简称《自查要点》)。
一、一般原则
化妆品安全评估人员应按照《化妆品安全评估技术导则》及相关法规和技术标准要求,同时根据产品的具体特性和实际使用情况,全面、准确、规范地开展化妆品安全评估,形成化妆品安全评估报告。
质量安全责任人应按照《自查要点》对产品安全评估报告开展自查,形成安全评估结论。质量安全责任人也可授权安全评估责任人完成安全评估结论。
化妆品注册人、备案人对产品安全性和资料的真实性承担主体责任。
二、安全评估报告自查内容
(一)产品简介
1.产品使用方法
产品使用方法应包括产品使用部位、使用频次等信息。产品使用部位可参考《化妆品分类规则和分类目录》的要求,也可根据产品特点,进一步细化和明确。例如,腮红类产品仅用于面部特定区域,使用部位可描述为“面颊部”, 氧化型染发类产品为间歇性使用产品,其说明书标注使用间隔长于1个月,其使用频次可描述为“1次/月”。
2.日均使用量
产品日均使用量应合理,需明确其参考依据。可参考国际权威机构公布的最新暴露量数据或公开发表的化妆品暴露量相关研究文献中的数据;如无公开发表数据的,可基于对产品实际用量的测试和统计结果,评估产品日均使用量,如可采用企业自主进行消费者试验和调研统计的有效数据等。
3.产品驻留因子
应根据产品类型、产品特点、产品使用方法选取合适的产品驻留因子,可参考国际权威机构公布的最新暴露量数据或公开发表的化妆品暴露量相关研究文献中的数据。使用方式相同或类似的产品其驻留因子可互相参考。
(二)原料的安全评估证据类型
化妆品原料的安全评估可采用以下证据类型:
1.《化妆品安全技术规范》
使用《化妆品安全技术规范》中的限用组分、准用防腐剂、准用防晒剂、准用着色剂和准用染发剂列表中的原料,应明确《化妆品安全技术规范》中的具体列表名称,并评估是否符合其要求。
2.国内外权威机构评估结论
国内外权威机构如美国化妆品原料评价委员会(CIR)、欧盟消费者安全科学委员会(SCCS)等有化妆品使用相关评估结论的,在符合我国相关法规及其使用条件下可将其评估结论用于原料评估,不需要对每个毒理学终点进行评估。
CIR通常将结构类似、毒理学性质相近的原料归为同组原料一并进行安全评估,因此在应用CIR评估结论时需对拟评估原料与同组原料的结构、毒理学性质进行分析,明确可应用评估结论的依据。
当原料的使用条件或者实际暴露情况不在SCCS或者CIR评估报告的适用范围时,可采用SCCS或CIR报告中的原料的某些毒理学终点数据,按照风险评估程序,对该原料在实际暴露场景下的各个毒理学终点进行评估。
SCCS或CIR报告中有限制使用条件的原料,应在满足限制条件的情况下采用其评估结论,如:CIR报告对某个原料的评估结论为“当原料在配方中无刺激性/致敏性时,该原料用于化妆品是安全的”,可采用本产品的人体(满足伦理要求的前提下)或毒理学试验数据评估认为对消费者不具有刺激性/致敏性,采用该原料的评估结论。
世界卫生组织(WHO)、联合国粮农组织(FAO)、欧洲食品安全局(EFSA)、欧洲药物管理局(EMA)、美国食品药品监督管理局(FDA)以及我国食药部门等已公布的安全限量或结论如化妆品安全使用结论、每日允许摄入量、每日耐受剂量、参考剂量、一般认为安全物质(GRAS)等,国际日用香料协会(IFRA)已发布的香料原料标准等,在符合我国化妆品相关法规规定的情况下,可采用相关结论。只有系统毒性评估结论的,应对产品或原料的刺激性等局部毒性进行评估后,采用其限量或结论。如不同的权威机构的限量值或评估结果不一致时,应根据数据的可靠性和相关性,科学合理地采用相关评估结论。
3.其他证据类型
对具有安全食用历史、3年安全使用历史的原料评估,应用毒理学关注阈值、交叉参照等方法的原料评估,可参照《化妆品安全评估技术导则》及相关技术指导文件的要求开展评估,需要对是否满足应用上述证据类型的前提条件进行详细分析。
4. 对于无法使用上述任一证据类型的原料,应当按照《化妆品安全评估技术导则》的风险评估程序对原料开展危害识别、剂量反应关系评估、暴露评估和风险特征描述,通过原料的毒理学评估资料、评估过程、结果及结论或产品毒理学试验数据证明产品安全性。
4.1危害识别
基于原料的来源、理化特性、稳定性、制备工艺及其毒理学试验、临床研究、人群流行病学调查、不良反应监测等数据,并结合产品的配伍特点、使用方法、使用部位等,识别该原料在暴露情况下是否对人体产生不良效应。
4.1.1原料毒理学终点的评估
毒理学终点的评估优先采用《化妆品安全技术规范》收录的试验方法开展的测试数据,也可以采用国际通行方法开展试验得到的测试数据。此外,在满足伦理要求的前提下,可采用人体试验测试数据。对每个试验数据的试验方法、结果、结论进行分析,确定原料的主要毒性特征及程度。使用动物试验替代方法的测试数据时,需考虑替代方法整合测试与评估策略,如可选择皮肤致敏有害结局路径(Adverse Outcome Pathway,AOP)框架下的“3选2”组合策略。
根据原料的化学结构特点,对原料进行充分分析或测试能够证明其不具有紫外线吸收特性的,可豁免对皮肤光毒性的评估。例如,在290 nm-700 nm波长范围内的摩尔消光系数(Molar Extinction Coefficient,MEC)小于1000 L mol-1cm-1,则该物质的光反应性较低,不足以引起皮肤光毒性。
基因水平和染色体水平上的毒理学试验结果均未显示原料具有遗传毒性,且重复剂量毒性中未发现致癌性相关指标异常,也没有其他已有证据显示有相关危害,经同行专家对上述相关资料进行充分分析,同行专家出具可免除致癌性试验的评估报告,确认无潜在的致癌风险,可豁免对其致癌性毒理学试验数据的评估。
4.1.2 受试物形式
对宣称具有祛斑美白、防脱发功能的原料进行评估时,采用毒理学试验的测试数据时,受试物原则上应为待评估物质,但对于在原料生产或贮存过程中由于技术上不可避免原因导致多种成分同时存在的,受试物可为复配原料,同时需说明两种或两种以上成分不可避免共同存在的必要性和科学性,并提供其相关研究资料、原料组成及相关比例。
对上述功能之外的原料进行评估时,采用毒理学试验的测试数据时,受试物通常是待评估物质,也可为含该成分的复配原料,或者含该原料的配方体系近似的产品,测试浓度应当能够覆盖该原料在配方中的使用浓度。
4.2 剂量反应关系评估
未观察到有害作用的剂量(NOAEL)或基准剂量(BMD)一般采用原料的系统毒性动物试验如重复剂量毒性试验、生殖发育毒性试验、慢性毒性/致癌试验等的数据。如果采用28天重复剂量毒性试验的NOAEL值,应增加不确定因子3倍。如果无法获得NOAEL值或BMD值,可采用观察到有害作用的最低剂量(LOAEL)计算安全边际值(MoS),但应增加不确定因子3倍。
如有多个NOAEL值或BMD值可供选择时,在遵循证据权重、相对保守的原则下,根据数据的可靠性和相关性选择合理的NOAEL值或BMD值以计算安全。
4.3 暴露量的评估
4.3.1 应根据评估需要选取合适的暴露计算公式。一般产品使用成人体重(60kg),特定人群使用的产品,应使用相应体重进行暴露计算,如儿童体重(8kg)。暴露量计算公式包括:
(1)全身暴露量(SED)=日均使用量×驻留因子×成分在配方中百分比×经皮吸收率÷体重;
(2)全身暴露量(SED)=以单位体重计的化妆品每天使用量×在产品中的浓度(%)×经皮吸收率(%);
(3)消费者(局部)暴露水平(CEL)=日均使用量×驻留因子×成分在配方中百分比×经皮吸收率÷产品使用面积 (在需要进行皮肤致敏定量评估时,需增加该暴露水平计算)。
4.3.2有吸入暴露可能的产品,计算暴露量时应同时考虑经呼吸道暴露量和经皮暴露量。可采用二室模型计算经呼吸道的暴露量。
吸入暴露量(SED吸入)= (一室模型吸入暴露量 + 二室模型吸入暴露量)× 肺部吸入分数 × 可吸入组分含量 × 使用频率/体重 。
其中,一室模型吸入暴露量 = 可吸入成分量 × 吸入率 ×一室模型暴露时间/一室模型体积
二室模型吸入暴露量 = 可吸入成分量 × 吸入率 ×二室模型暴露时间/二室模型体积
可吸入成分量 = 产品单次使用量 × 成分在配方中百分比 × 空气传播分数
总暴露剂量(SED总)= SED吸入 + SED经皮
4.4风险特征描述
根据公式
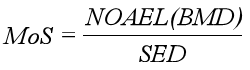
计算原料的安全边际值。当MoS≥100时,一般可以判定原料是安全的,但如果毒理学数据质量存在缺陷,MoS值应适当增加。当MoS<100,则认为原料具有一定的风险。
根据公式
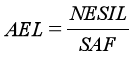
计算潜在致敏物质的可接受暴露水平(AEL)。当AEL高于全身暴露量时,认为该原料引起致敏性的风险在可接受范围内。
5.特定类型化妆品原料的安全评估
(1)香精
应按照《化妆品安全评估技术导则》的原则和要求对香精进行评估,或明确产品所用香精符合国际日用香料协会(IFRA)实践法规要求或符合我国相关(香精)国家标准。
产品配方表中同时填写“香精”及香精中的具体香料组分的,应当提交香精原料生产商出具的关于该香精所含全部香料组分种类及含量的资料,并对每种香料组分进行安全评估。儿童化妆品中的香精、植物精油(芳香剂)或香料成分,需对其中的致敏成分进行识别并评估。
(2)纳米原料
产品配方中含有纳米原料,应明确包括纯度、晶型、初始粒径分布、表面涂层物质等信息的原料质量规格,并基于该原料的质量规格,对配方使用量下的纳米原料进行安全评估,同时应对评估所用的毒理学试验方法是否适用于纳米原料检测进行说明。
由于纳米原料粒径较小,存在较高吸入暴露风险,因此不鼓励在可能存在吸入暴露风险的产品中使用纳米原料。
(3)染发产品中的着色剂
氧化型染发产品中含有准用着色剂表收录的有机着色剂(如硬脂酸钙、CI 73385、CI 45100等),且其使用目的为“着色剂”的,由于有机着色剂可能参与氧化还原反应,存在潜在安全风险,应对有机着色剂在氧化型染发产品使用条件下的安全性进行评估。
(4)未填入配方的成分
在对原料进行评估时,同时应对不作为配方成分的极其微量成分(如为了保证化妆品原料质量而在原料中添加的极其微量的成分;产品生产工艺中添加并在后续生产步骤中去除的加工助剂等)逐一进行说明并进行充分的安全评估,确保该类成分不会影响原料的质量安全。
(5)安全监测期新原料
对产品中使用的安全监测期新原料进行评估时,应评估该原料的使用目的、使用或适用范围、使用浓度、使用限制和要求等是否符合新原料的技术要求。
(三)化妆品安全性测试
化妆品中如含量较低的个别非功效原料(小于配方原料总数的5%)缺少评估数据而不能够完成安全评估的,可以参照《化妆品注册和备案检验工作规范》设置的毒理学试验项目,或者在满足伦理的前提下,采用人体试验开展产品的安全性测试,对产品的安全性进行综合评价分析。
(四)特殊情形产品的安全评估
1. 含推进剂的喷雾产品的评估
由于推进剂一般具有较强的挥发性,含推进剂的喷雾产品实际使用时,仅有微量的推进剂残留人体表面,因此,除推进剂外的配方原料在人体的暴露量为除去推进剂后的原料浓度,应当将推进剂与其他原料分开评估,其他原料的评估浓度应为扣除推进剂后配方(以100%计)中各组分的浓度;而推进剂可单独评估或按照其在配方中的使用浓度进行评估。
2.两剂或两剂以上必须配合使用的产品评估
两剂或两剂以上必须配合使用的产品,应根据产品的使用方法对混合后的原料含量进行评估。当产品实际使用时可能存在多种使用配比的情况时,还应对每种配比情况下分别对原料的累积含量进行评估。同时应结合相关文献研究资料或产品的实验研究数据,对原料之间是否存在化学和/或生物学相互作用而产生的潜在安全风险进行评估。
3. 必须配合仪器或者工具使用的产品评估
必须配合仪器或者工具(仅辅助涂擦的毛刷、气垫、烫发工具等除外)使用的化妆品,应当明确配合使用的仪器或者工具发挥作用的机理,评估配合仪器或者工具使用条件下的产品的安全性。配合使用的仪器或者工具不应具有化妆品功能,不应参与化妆品的再生产过程,不能改变化妆品与皮肤的作用方式和作用机理。
配合仪器使用的产品,如果仪器影响透皮吸收,评估时需要对原料的皮肤吸收率进行调整,一般应选用更为保守的经皮吸收率。
4. 儿童化妆品的安全评估
儿童化妆品评估时,应明确产品配方设计的原则,配方设计应遵循安全优先、功效必需、配方极简的原则,应从原料的安全、稳定、功能、配伍等方面,结合儿童生理特点和可能的应用场景,评估所用原料的科学性和必要性,特别是香料香精、着色剂、防腐剂、防晒剂及表面活性剂等原料。具体评估原则应符合《儿童化妆品监督管理规定》和《儿童化妆品技术指导原则》的规定。
(五)可能存在的风险物质的安全评估
应按照《化妆品安全技术规范》《化妆品安全评估技术导则》及《化妆品风险物质识别与评估技术指导原则(征求意见稿)》要求开展化妆品中风险物质的评估。根据《化妆品安全技术规范》规定、参考国内外权威机构风险评估结论、应用毒理学关注阈值或交叉参照等方法对化妆品中可能存在的所有风险物质进行识别与评估,如无法应用上述证据类型,应按风险评估程序对风险物质进行完整的安全评估。
(六)产品稳定性评估
应结合产品的具体情况评价相关理化指标以确定产品的稳定性;应对原料之间是否存在化学和/或生物学相互作用产生的潜在安全风险进行评估;并对与内容物直接接触的容器或载体的理化稳定性及其与产品的相容性进行评估。对配方体系近似、容器或载体相同的化妆品,可根据已有的资料和实验数据对理化稳定性进行评估,但需对其配方体系、包装材质进行分析说明。
(七)产品微生物学评估
应对产品中微生物进行评估,确定其微生物学指标要求符合《化妆品安全技术规范》的要求;对处于研发阶段的化妆品,可参考国际通用的标准或方法对其防腐体系的有效性进行评价。对于防腐体系相同且配方近似的产品,可参考已有的资料和实验数据进行产品安全性评价。根据产品特性,属于不易受微生物污染的产品,可不进行防腐效能评价,但应就相关情况予以说明。
(八)明确风险控制措施或建议
应基于产品特点和对化妆品原料和风险物质的评估结果,制定产品使用的风险控制措施和建议,比如明确产品的使用方法、使用频次、使用人群、警示用语和注意事项等。
(九)明确安全评估结论
通过对化妆品中各原料和可能存在的风险物质的安全评估,以及结合化妆品微生物和有害物质的检测结果、稳定性评估结果,制定的风险控制措施和建议等,获得明确的产品安全评估结论,从而确认产品在正常及合理、可预见的使用条件下,不会对人体健康产生危害。
附件2 化妆品安全评估结论

本化妆品为驻留类的面部护肤类化妆品,配方中使用纳米级CI77266作为色素,属于《化妆品安全评估资料提交指南》中的第二类化妆品。本企业已取得所在国(地区)政府主管部门出具的生产质量管理体系相关资质认证并有效实施,且能够提供纳米原料的安全评估资料,因此,本次备案仅提交化妆品安全评估结论,安全评估报告存档备查。
二、产品简介
本化妆品为驻留类的面部护肤类化妆品,适用于面部,化妆品日均使用量为1540 mg/d,驻留因子为1,使用频次为2次/天。
三、安全评估结论
配方中包含水、甘油、1,3-丙二醇、聚二甲基硅氧烷、苯氧乙醇、PEG-100 硬脂酸酯、生育酚(维生素E)、向日葵(HELIANTHUS ANNUUS)籽油,CI77266(纳米级)、香精……n种原料,均为《化妆品安全技术规范》(2015年版)或者《已使用化妆品原料目录》中的物质,或者为已注册或备案的新原料。
按照《化妆品安全评估报告自查要点》原则和程序对化妆品中每种原料、可能存在的风险物质、化妆品稳定性、化妆品包装相容性、微生物学等内容的评估进行了自查,形成安全评估报告小结(附1),并提交了CI77266(纳米)的安全评估资料(附2)。
结果显示,该化妆品在正常、合理的及可预见的使用条件下不会对人体健康产生危害。
附:
1.化妆品安全评估报告小结
2. 纳米级CI77266安全评估资料
自查人员签名
质量安全责任人:xxx
授权安全评估责任人:xxx
日期:20xx年xx月xx日
地址:xxxxxxxxxxxxxxxx
相关阅读:
2024中国化妆品重点合规动态之3月回顾:药监局将优化化妆品安全评估管理








 化学品合规
化学品合规
 化妆品合规
化妆品合规
 检验检测
检验检测
 安全管理智能化
安全管理智能化
 绿色低碳可持续
绿色低碳可持续
 药品合规
药品合规
 食品合规
食品合规
 食品接触材料/再生塑料
食品接触材料/再生塑料
 中国农药登记
中国农药登记
 境外农药登记
境外农药登记