在之前的文章《外泌体申请INCI名称合规要点(附国际外泌体监管情况)》里,我们介绍了什么是外泌体产品。外泌体是细胞外囊泡(extracellular vesicles, EVs)中的一个亚群,直径约为20~200 nm(纳米),包含了蛋白质、脂质、多糖及RNA等物质,通过作用于靶细胞,外泌体在细胞间信号转导和信息传递中发挥重要作用。
外泌体来源于多种细胞,不同细胞分泌的外泌体含有不同的生物学功能。具体来看,植物外泌体的研究相较动物和人体领域的研究较为有限。植物外泌体是植物细胞分泌的纳米级小囊泡,直径约为40~150nm,内含DNA、小RNA、微小RNA和蛋白质等物质,介导细胞间的信号转导和信息传递。
美国上市的外泌体原料
目前各个国家和地区对外泌体的监管一般都对人源外泌体和非人源外泌体进行区分式管理,整体来说,人源外泌体的管理更加严格。美国是目前没有对外泌体提出专门管理规定的国家之一。那么,在美国市场,目前有哪些外泌体原料上市了呢?
妆研通过两个途径进行了收集,第一是美国个人护理品协会(PCPC)wINCI线上数据库中已收录的外泌体相关INCI名称,第二是美国FDA药品评价与研究中心(CDER)公布的DMF产品名。虽然不能完全覆盖美国市场上的外泌体原料,但可以作为企业的一个参考。
表1 PCPC线上数据库中收录的含“Exosomes”的INCI名称(统计截至2025年2月)

表2 CDER最新公布的DMF清单中带“Exosomes”的产品(统计截至2025年2月)
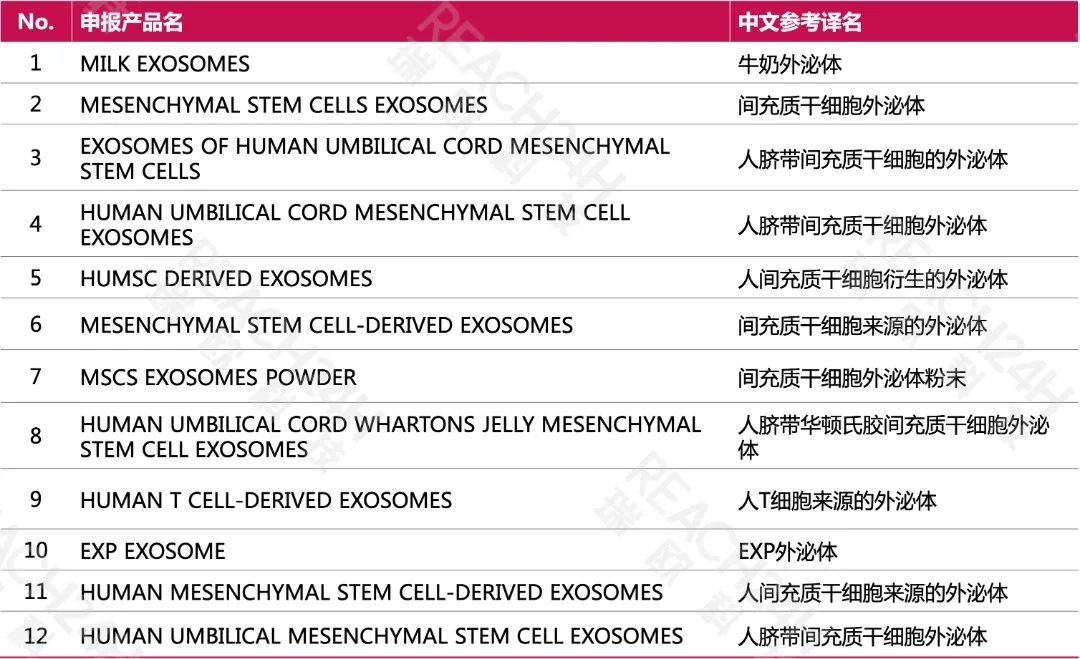
从上面的表格中可以发现,PCPC线上数据库中已收录的外泌体相关INCI名称共24个。人源外泌体最多,其余有鹿源外泌体、海洋生物源外泌体、牛奶外泌体等。CDER公布的DMF产品名中含外泌体的共有12个,大部分还是人源外泌体,比如各类间充质干细胞外泌体有9个。
美国外泌体申请提示
虽然美国目前没有对外泌体提出专门管理规定,但按照美国化妆品和药品法规的原则,企业仍然是保证产品安全的责任主体,加上美国鼓励消费者对于不安全/违反消费者知情权的产品进行群体诉讼,因此企业在将产品投放美国时仍需要把控产品质量,以免在事后监管时承担高额的违规成本,比如可以考虑依据现有的申请渠道做好自身产品评估和资料整理。
外泌体INCI名称申请一般需要提供以下资料:商品名、成分说明、主要功能、来源细胞/组织、生产工艺简述、外泌体和来源细胞的鉴定资料、外泌体纯度等。
外泌体DMF申请一般需要提供以下资料:名称、结构、生产商信息、工艺控制信息、物料控制信息、杂质研究信息、质量标准、验证信息、稳定性研究等。
而参考日本和韩国对于人源外泌体的要求,一般也会重视捐赠者的健康信息、生产工艺、细胞培养/生产过程中的质量管理、培养基成分、产品稳定性、病原细菌/病毒/血清测试等方面。
相关阅读:
INCI名称申请2025年审定会议安排公布,提醒企业提前准备相关资料







 化学品合规
化学品合规
 化妆品合规
化妆品合规
 检验检测
检验检测
 安全管理智能化
安全管理智能化
 绿色低碳可持续
绿色低碳可持续
 药品合规
药品合规
 食品合规
食品合规
 食品接触材料/再生塑料
食品接触材料/再生塑料
 中国农药登记
中国农药登记
 境外农药登记
境外农药登记