外泌体可以说是近年来生物医学领域比较关注的热点,其主要应用前景在医美抗衰,组织损伤修复和再生,肿瘤治疗,抗炎和免疫调节等领域。鉴于外泌体广阔的应用场景,初创企业如雨后春笋,纷纷涌入这一赛道。
而就在近日,杭州瑞欧科技有限公司子公司——瑞欧佰药(杭州)医药科技有限公司协助北京恩康医药有限公司自主研发的人源间充质干细胞外泌体药物原料,成功拿到DMF II型备案资格(备案号:040337)。
美国DMF法规概述
Drug Master File (DMF),即药物主文件,是呈交美国FDA的存档待审资料。资料内容包括有关在制造、加工、包装、储存、批发人用药品活动中所使用的生产设施、工艺流程、质量控制及其所用原料、包装材料等详细信息。
DMF作为一种参阅性资料在FDA中心档案室(Central Document Room,CDR)存档,用于一种或多种临床研究申请(IND)、创新药申请(NDA)、简化新药申请(ANDA)、出口申请、以及上述各种申请的修正和补充。
美国DMF登记注册流程
DMF登记类型
FDA对DMF有以下分类:
l 型:生产厂址、设施与设备、标准操作程序和人员
II 型:原料药、中间体及其使用的原料,或药物制剂
III 型:包装材料/容器
IV 型:辅料 / 赋形剂,着色剂,香料及其使用的原料
V 型:可被 FDA 接受的其他信息
*注:2000年后,FDA已不再接受Type I型DMF文件。
DMF申报资料要求
DMF登记资料使用e-CTD格式递交。其中,III型DMF可以选择纸质版和e-CTD格式递交,纸质版关闭节点在2022年2月。
e-CTD格式的DMF可通过FDA的ESG(Electronic Submission Gateway)递交;对于超过10GB 的注册资料,可用物理媒介递交,例如光盘等。
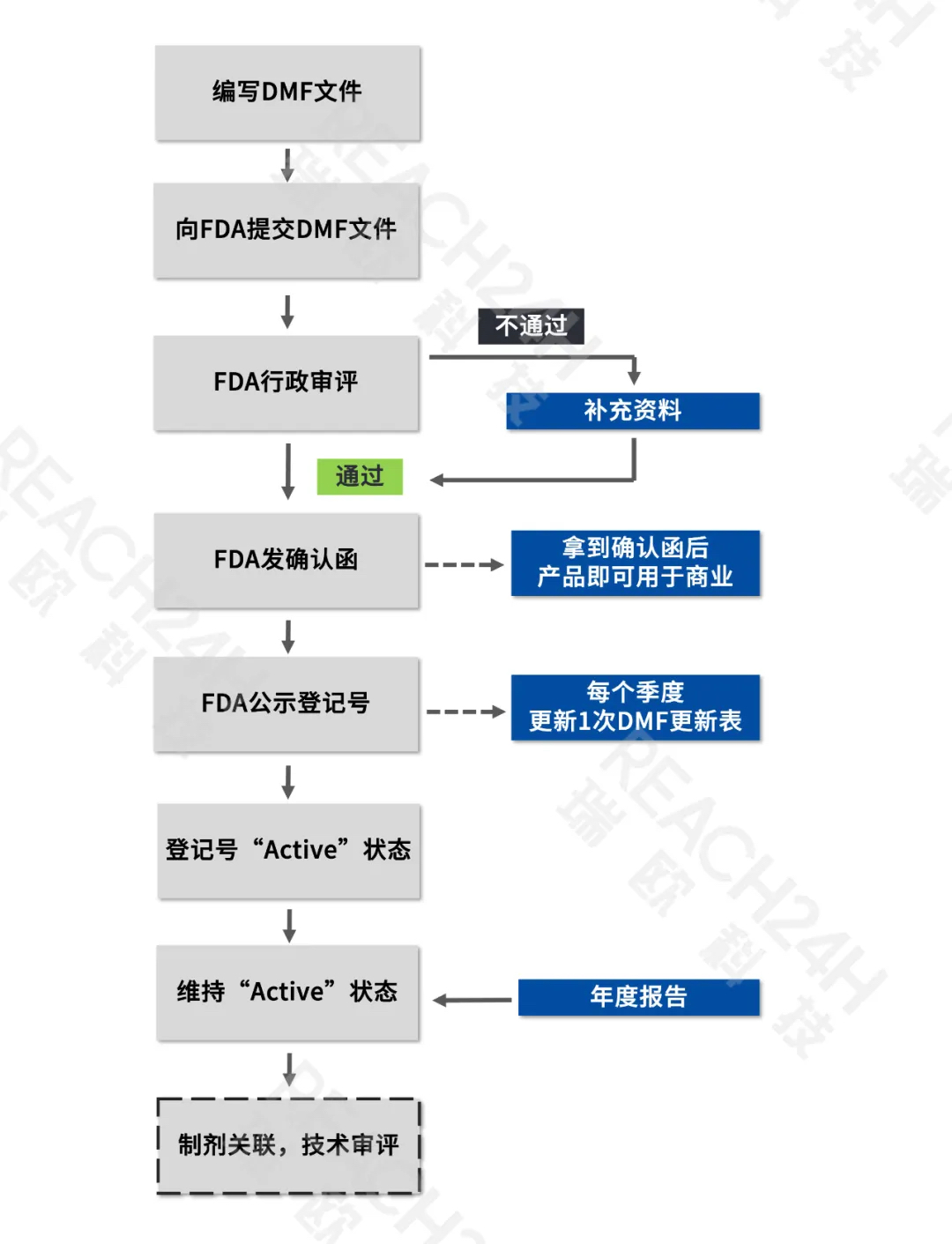
DMF登记流程
DMF登记常见的QA
Q:DMF登记是否一定需要美国代理?
A:虽然DMF申报并未强制要求其代理是常驻美国的,但FDA仍建议公司采用常驻美国的代理。采用代理可以免去配备e-CTD软件以及注册电子提交端口(ESG)账号的麻烦。
瑞欧科技可以提供美国子公司(REACH24H USA INC)的ESG账号和e-CTD软件,缩短企业的登记时间。
Q:DMF资料提交后,多久可以拿到登记号?
A:DMF文件提交后,FDA会启动行政审评,主要审评内容是格式上的审核以确认提交文件符合FDA的文件格式要求。行政审评时间约为2-3周,审评通过即给予DMF号。
Q:如果去年没有提交DMF年报,“A”(Active)是否会转化为“I”(Inactive)?
A:如果DMF文件在3年内没有进行任何修订或递交年度报告,FDA将启动关闭程序。因此,如果只是1年没有提交年报,“A”状态不会被强制关闭,但是后续还是需要补充提交年报。
DMF登记成功案例
当前,瑞欧佰药已完成70余项美国DMF的合规业务,其中包括不限于:
DMF II 类:层析介质类,外泌体,干细胞株类,冻存液,培养基类,蛋白辅助因子类,化学原料药类等30余项。
DME III 类:高密度聚乙烯桶/瓶,冻存袋/多层共挤袋,聚丙烯组合瓶盖系统/铝塑组合盖,离型膜:预灌封注射器/笔式注射器,吸入剂及注射剂用瓶/安培瓶等20余项。
DMF IV 类:药用微载体,海藻酸钙;胶化烃;纤维素类;聚乙二醇;明胶;聚维酮;蜂蜜;甘露醇等20余项。






 化学品
化学品
 食品接触材料
食品接触材料
 化妆品
化妆品
 绿色双碳
绿色双碳
 境外农药登记
境外农药登记
 中国农药登记
中国农药登记