随着毒理学学科的延伸与发展,越来越多的研究工具和评估方法被开发出来,以替代传统的动物试验,一方面能更好地保障动物福利,另一方面也可以实现更高通量的评估效率。这些替代方法包括了化学测试(in chemico)、体外测试(in vitro)和计算机模拟(in silico),并可应用于皮肤致敏、皮肤刺激/腐蚀、基因毒性等毒性节点方面。但是在不少替代方法的实际使用过程中,受限于单个方法本身的局限性,通常需要采用多组替代方法并结合专家评价的方式得出最终的结论以用于法规需求。为了提高替代方法在化学品法规应用方面的适用性与规范性,经济合作与发展组织(OECD)于2021年7月首次发布了一类限定方法(Defined Approach, DA)来用于评价化学品的皮肤致敏性。该方法被采纳为OECD TG 497,主要基于皮肤致敏的有害结局(Adverse Outcome Pathway, AOP)框架,通过限定的几组替代方法采用规范化流程来完成对目标化合物评估致敏性的评价。
有害结局路径(AOP)与皮肤致敏作用机制
有害结局路径(Adverse Outcome Pathway, AOP)最核心的内容在于规范化和模块化了从分子、细胞、组织、器官及至最终个体与群体水平的一系列毒性发生事件,并强调以逻辑推理性来确定这些毒性发生事件的前后关系。在AOP框架中,毒性事件可以具体分为分子起始事件(Molecular Initiating Event, MIE; 在OECD指南中也被定义为Key Event 1, KE1),关键事件(Key Events, KEs)和有害结局(Adverse Outcome, AO)这三大类,而各个过程则是通过关键事件关系(Key Event Relationships, KERs)进行连接。简单地来说,皮肤致敏事件可以理解为由一个分子起始事件开始,从而导致多个关键事件的发生,最后终结于“过敏性接触性皮炎”这一有害效应的过程。
有关于AOP的详细介绍可以查看瑞欧之前发布过的专家文章:有害结局路径(AOP):从毒性作用机制出发的化学品风险管理策略 以欧盟植物保护产品内分泌干扰评估为例
皮肤致敏限定方法的开发即是建立于皮肤致敏的AOP框架之中(AOP ID: 40; OECD Project: 1.1),皮肤致敏过程分为诱导阶段和随后的免疫反应激发阶段。第一个阶段主要的分子起始事件(MIE, 即KE1)为外源物质与皮肤蛋白的共价结合,形成半抗原。随后触发了两个细胞水平的关键事件(KEs),其中KE2为角质细胞炎症反应;KE3则是树突状细胞的激活。第三个关键事件(KE4)则发生在器官水平,其过程为KE3中经活化的树突状细胞迁移至局部淋巴结,并向初始型T细胞递呈组织相容性复合物(MHC),从而导致记忆T细胞的增殖与分化。而一旦此个体的皮肤再次接触原外源化合物时,则会进入免疫反应激发阶段,最终造成有害结局(AO):过敏性接触性皮炎的发生。
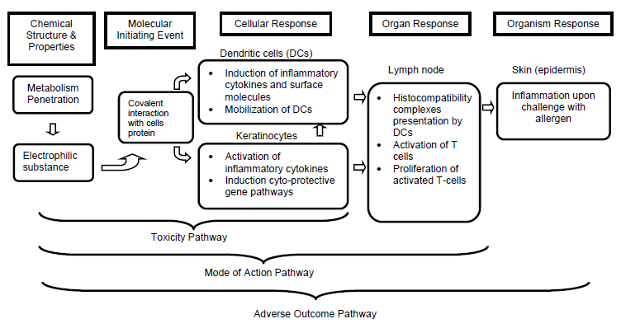
皮肤致敏的AOP框架
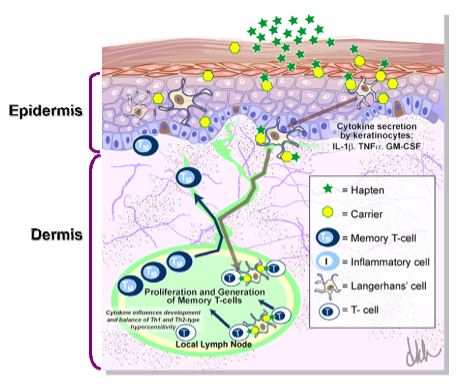
皮肤致敏过程的诱导阶段
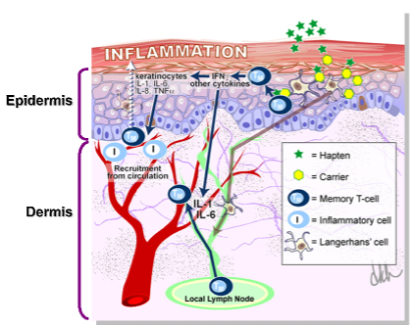
皮肤致敏过程的激发阶段
与关键事件(KE)相关的皮肤致敏试验方法
基于已建立的皮肤致敏的AOP框架,截止到目前针对于KEs已经有开发了一系列测试方法,且部分已被OECD测试指南收录为标准方法。针对这部分被OECD测试指南收录的方法总结如下:
皮肤致敏的体外测试方法 | ||
MIE, 即KE1 |
| 1. 直接多肽反应试验(DPRA),2015被采纳为OECD TG 442C 2. 氨基酸衍生物反应试验(ADRA),2019年增补为OECD TG 442C |
KE2 |
| 1. 基于抗氧化响应元件(ARE)-转录因子NF-E2相关因子2(Nrf2)的荧光素酶检测方法,其中ARE来自人源AKR1C2基因(KeratinoSensTM),2015年被采纳为OECD TG 442D 2. 基于抗氧化响应元件(ARE)-转录因子NF-E2相关因子2(Nrf2)的荧光素酶检测方法,其中ARE来自大鼠NQO1基因(LuSens),2018年被增补为OECD TG 442D |
KE3 |
| 1. 检测人体单核白血病细胞系THP-1细胞中CD86和CD54的表达(h-CLAT),2016年被采纳为OECD TG 442E 2. 骨髓U937皮肤致敏试验(U-SensTM),2018年增补为OECD TG 442E 3. 白细胞介素-8报告基因试验(IL-8 Luc),2018年增补为OECD TG 442E |
皮肤致敏的体内测试方法 | ||
KE4 |
| 1. 皮肤致敏:局部淋巴结试验(LLNA,放射性检测法),OECD TG 429 2. 皮肤致敏:局部淋巴结试验(DA法),OECD TG 442A 3. 皮肤致敏:局部淋巴结试验(BrdU-ELISA法),OECD TG 442B |
AO |
| 1. 皮肤致敏试验(Buehler试验(BT)/豚鼠最大化试验(GPMT)),OECD TG 406 |
限定方法(DA)与整合测试和评估方法(IATA)的比较
虽然基于皮肤致敏AOP框架已开发了上述一系列的体外测试方法,但由于皮肤致敏反应机制涉及多因素、多水平的复杂分子生物学过程,因此单一的体外测试方法并不能保障对目标化合物的皮肤致敏性有足够的预测能力。基于这一原因,皮肤致敏整合测试和评估方法(integrated approach to testing and assessment, IATA)应运而生。具体而言,IATA运用了多组体外测试结果并结合了专家评价来综合判断目标化合物是否具有皮肤致敏性,但显而易见的是这种方式并不能完全适用于法规需求中的决策目的,最主要的影响条件在于不同专家评价结果可能会导致开放性的结论,造成无法对目标化合物的皮肤致敏性评估达成统一性判断。
为了让替代方法更能够满足法规需要,逐渐发展而来的限定方法(Defined Approach, DA)与IATA最大的差异在于不再依赖专家评价,仅采用限定的几组体外试验结果,即可对目标化合物完成致敏性评估。除此之外,通过按规定流程结合(Q)SAR预测的方式,DA也能够进一步得出法规所需的统一危害分类结果。
皮肤致敏限定方法OECD TG 497的评估流程
在OECD TG 497中,皮肤致敏性的限定方法主要有如下3种:
从一组in chemico 试验(KE1, OECD TG 442C: DPRA)和两组in vitro 试验(KE2, OECD TG 442D: KeratinoSensTM; KE3, OECD TG 442E: h-CLAT)中采用“3选2(2o31)”的限定方法对目标化合物的皮肤致敏性进行危害识别。
通过采用一组in chemico试验(KE1, OECD TG 442C: DPRA)、一组in vitro试验(KE3, OECD TG 442E: h-CLAT)与一组in silico方法(Derek Nexus)的结果形成整合测试策略(ITSv12),基于EG DASS3专家组发展而来的数据解释步骤(DIP4)来对目标化合物的皮肤致敏性得出UN GHS危害分类结论。
通过采用一组in chemico试验(KE1, OECD TG 442C: DPRA)、一组in vitro试验(KE3, OECD TG 442E: h-CLAT)与一组in silico方法(OECD QSAR Toolbox)的结果形成整合测试策略(ITSv22),基于EG DASS3专家组发展而来的数据解释步骤(DIP4)来对目标化合物的皮肤致敏性得出UN GHS危害分类结论
2o3: 3选2(2 out of 3)
ITSv1或ITSv2: 整合测试策略v1或v2(integrated testing strategy version 1 or version 2)
EG DASS: 皮肤致敏限定方法开发专家组(Expert Group on Defined Approaches for Skin Sensitisation)
DIP: 数据解释步骤(Data interpretation procedure)
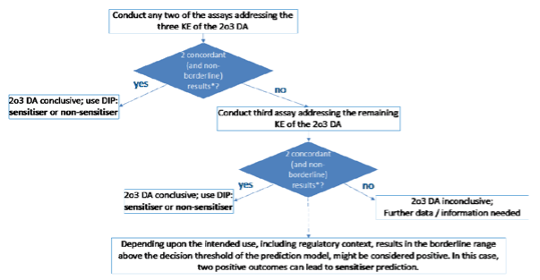
2o3皮肤致敏限定方法的决策树
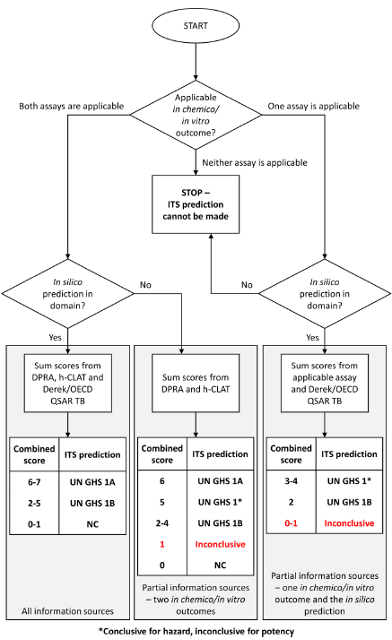
ITSv1/ITSv2皮肤致敏限定方法的决策树
皮肤致敏限定方法的性能评估
虽然受限于数据集的大小,但在OECD TG 497中也尽可能地评估了三种限定方法对皮肤致敏的预测性能(如下图所示)。可以发现的是当前这三种限定方法已在准确度(Balanced Accuracy, BA)、灵敏度(Sensitivity, Sens)和特异性(Specificity, Spec)方面均基本能满足法规需求,且与IATA相比也不再需要额外的专家评价,因此该限定方法的开发极大提升了替代方法应用于皮肤致敏评估时的适用性与规范性。
但仍需要注意的是这些限定方法仍受限于具体的替代方法本身(如DPRA, KeratinoSensTM和h-CLAT对于Log P > 3.5的目标化合物预测灵敏度较低;金属化合物不适用于DPRA试验等),以及当出现不明确的结论时还需要进一步的分析策略。
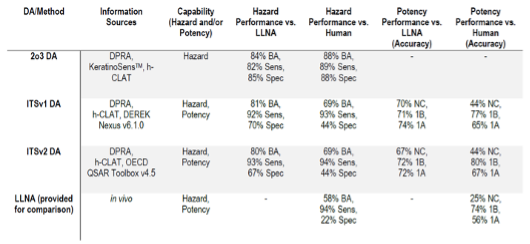
三种限定方法与LLNA方法在预测OECD标准物质致敏性的表现
随着替代方法成为化学品安全性评价中发展的新趋势,瑞欧科技也立足技术演进,积极布局替代方法在化学品、化妆品、农药、药品等方面的应用,综合运用计算化学、(Q)SAR、体外试验等解决皮肤致敏、皮肤刺激/腐蚀、基因毒性等评估中所面对的实际问题。
对于非测试方法,瑞欧科技可为客户提供多达十几种(Q)SAR软件预测与专家评估服务。同时,为了进一步提高预测结果的有效性和可靠性,瑞欧科技也于近期与全球知名的信息平台Lhasa开展正式合作,将领先的(Q)SAR预测系统Derek Nexus & Sarah Nexus纳入为客户提供服务的软件工具中。在限定方法OECD TG 497中,整合测试策略(ITSv1)的in silico方法使用的即是Derek Nexus v6.1.0。在2020年约翰霍普金斯动物试验替代中心主导开展的一项针对皮肤致敏性节点的计算机模拟方法评估的研究中,Derek Nexus在Basketter数据集和HSDB数据集中均表现出了良好的适用性和准确度。瑞欧科技希望,通过与商业软件平台开展更全面的合作,能够向客户提供更高质量的毒理学节点的评估服务,同时也参与到替代方法在化学品、化妆品、农药、药品等行业的深入推广中去。

Derek Nexus介绍 - 规则模型(Rule-based models)
Derek Nexus是欧盟农药等同性评估和其他(如巴西)国家农药监管机构推荐使用的(Q)SAR软件预测系统,也被医药监管机构FDA、EMA和NMPA所广泛采用。
特点:
基于毒理学专家数十年的经验积累
涵盖数百种结构警报,并对难预测的毒性结构如芳香胺等充分优化
广泛的毒理学节点:基因毒性、皮肤致敏性、致癌性、生殖/发育毒性、神经毒性等
高度透明,所有毒理学评估依据、文献来源均可获取

Sarah Nexus介绍 - 统计模型(statistic-based models)
Sarah Nexus基于一种新颖的层次聚类模型SOHN方法来自学习训练集中的碎片化分子结构,通过这种机器学习方法从而灵敏的识别目标分子中与基因毒性相关的结构特征。
特点:
高灵敏度的预测方法,与Derek Nexus配合使用能极大提高预测的有效性与可靠性
基于可靠、海量的Ames致突变试验数据
训练集通过了充分的可靠性验证,能够提供可信的数据来源
高度透明,具有完备的推理过程
参考文献
[1] 程树军, 王慧. 预测毒理学与替代方法. 2020.
[2] OECD. Guideline No. 497: Guideline on Defined Approaches for Skin Sensitisation. 2021.
[3] OECD. The Adverse Outcome Pathway for Skin Sensitisation Initiated by Covalent Binding to Protein, Part 1: Scientific Evidence. Series on Testing and Assessment, No. 168. 2012.
[4] OECD. The Adverse Outcome Pathway for Skin Sensitisation Initiated by Covalent Binding to Protein, Part 2: Use of the AOP to Develop Chemical Categories and Integrated Assessment and Testing Approaches. Series on Testing and Assessment, No. 168. 2012.
[5] Golden, E., Macmillan, D. S., Dameron, G., Kern, P., Hartung, T. and Maertens, A. (2021) “Evaluation of the global performance of eight in silico skin sensitization models using human data”, ALTEX - Alternatives to animal experimentation, 38(1), pp. 33-48. doi: 10.14573/altex.1911261








 化学品合规
化学品合规
 化妆品合规
化妆品合规
 检验检测
检验检测
 安全管理智能化
安全管理智能化
 绿色低碳可持续
绿色低碳可持续
 药品合规
药品合规
 食品合规
食品合规
 食品接触材料/再生塑料
食品接触材料/再生塑料
 中国农药登记
中国农药登记
 境外农药登记
境外农药登记