统一授权适用于单个生物杀灭剂产品的授权或者在欧盟具有相似使用条件的产品组的授权。但是申请统一授权是有前提的,BPR法规第42条规定,统一授权是根据产品的使用条件划分的,针对的是在欧盟境内具有相似使用条件的生物杀灭剂产品,旨在为将多个成员国市场作为目标市场的申请者提供简化的程序,减轻整体的行政管理负担。但是若产品中含有的活性物质符合排除标准(例如致癌、致畸或具有生殖毒性的物质),或者属于PT14(杀鼠剂)、PT15(杀害鸟剂)、PT17(杀鱼剂)、PT20(其他脊椎动物防治剂)、PT21(防污剂)等产品类型,则不适用。
获得生物杀灭剂产品在欧盟层面的统一授权的步骤如下:
1.明确产品进行统一授权的时间
统一授权的具体实施时间取决于生物杀灭剂产品中含有的活性物质:
1)若生物杀灭剂产品中含有的活性物质为新活性物质,那么从2013年9月1日起,可以申请统一授权;
2)若生物杀灭剂产品中含有的活性物质为现有活性物质,则统一授权按产品类型划分为三个阶段:
- 从2013年9月1日起,开始接受PT1(人类卫生用生物杀灭剂)、PT3(兽医卫生用生物杀灭剂)、PT4(食品和饲料区域消毒剂)、PT5(饮用水消毒剂)、PT18(杀虫剂、杀螨剂和其他节肢动物杀灭剂)、PT19(驱避剂和引诱剂)的统一授权;
- 从2017年1月1日起,开始接受PT2(私人区域和公共区域消毒剂和其他生物杀灭剂)、PT6(贮存防腐剂)、PT13(金属加工液防腐剂)的统一授权;
- 从2020年1月1日起,开始接受其他产品类型PT7(涂膜防腐剂)、PT8(木材防腐剂)、PT9(纤维、皮革、橡胶和聚合物防腐剂)、PT10(建筑防腐剂)、PT11(液体制冷和加工系统防腐剂)、PT12(除黏菌剂)、PT16(软体动物杀灭剂)的统一授权。
2.申请准备——预提交
预提交的目的是让申请人明确以下几个问题:
- 申请的产品是否是BPR法规监管范围内的生物杀灭剂产品;
- 是否在欧盟的各个国家使用条件相似。
3.创建IUCLID 5卷宗
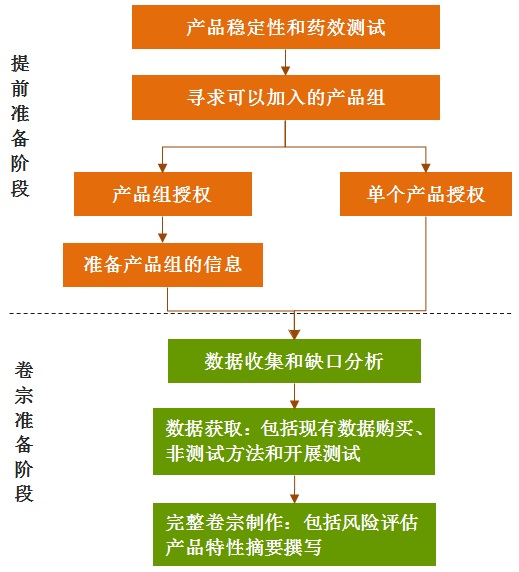
统一授权需要同时准备满足BPR法规附录II要求的活性物质数据(活性物质卷宗或LoA)、附录III要求的产品数据(产品卷宗或LoA)以及产品特性摘要。其中,产品卷宗包括:申请人、物质识别信息、理化特性、理化危害、分析方法、药效、用途和暴露、毒理、生态毒理、环境行为、保护人类动物和环境所采取的措施、分类标签、风险评估报告等。待相关数据节点准备完成,就可以利用IUCLID 5 创建卷宗。申请人可按以下流程(图1)进行准备:
4.卷宗提交与跟踪
1)通过R4BP递交申请
申请人需要将IUCLID 5卷宗通过R4BP提交,完成申请。
2)跟进授权申请
所有与产品授权相关的重要信息,ECHA都会通过R4BP通知申请人,包括申请的进展、费用的支付情况以及是否需要补充其他信息等,所以一定要及时通过R4BP查看信息的更新。
5.获得生物杀灭剂产品委员会(BPC,Biocidal Products Committee)授权意见
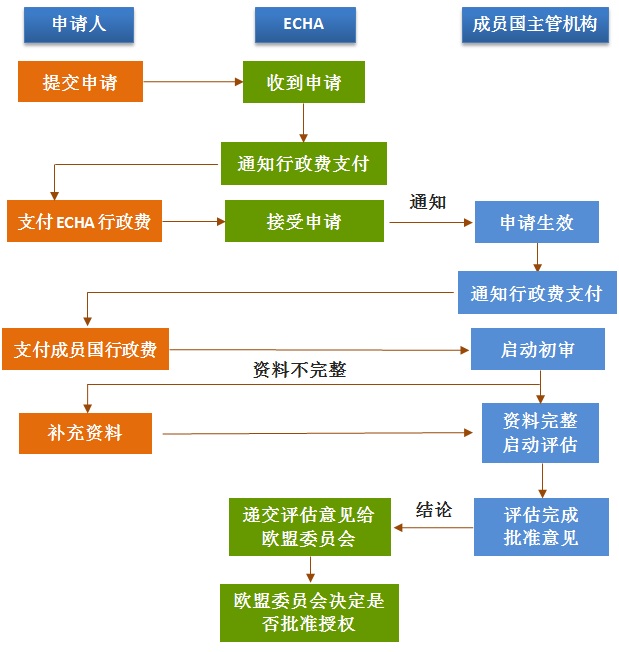
获得生物杀灭剂产品委员会关于统一授权意见后,申请人需要在30天内准备并向ECHA递交产品特性摘要(SPC,Summary of Biocidal Product Characteristics),SPC需要根据不同申请成员国的官方语言翻译成相应译文。欧盟委员会只有收到ECHA提交的SPC所有申请成员国官方译本后,才会对产品进行最终授权。统一授权的评估流程可参见图2:






 化学品合规
化学品合规
 化妆品合规
化妆品合规
 检验检测
检验检测
 安全管理智能化
安全管理智能化
 绿色低碳可持续
绿色低碳可持续
 药品合规
药品合规
 食品合规
食品合规
 食品接触材料/再生塑料
食品接触材料/再生塑料
 中国农药登记
中国农药登记
 境外农药登记
境外农药登记