12月4日,欧盟委员会卫生和食品安全局的Klaus Berend先生莅临由杭州瑞欧科技与赫尔辛基化学品论坛联合举办的CRACHCF 2020 特别峰会,Klaus Berend先生对欧盟生物杀灭剂法规(EU BPR, Regulation No 528/2012)从法规概况,目前进展以及近期发展做了系统全面的介绍。
1. EU BPR的法规框架
EU BPR法规监管通过非物理和机械手段,用于消灭、阻止、预防或控制任何有害生物的产品。此外也涵盖对处理物品的监管,例如具有抗菌除臭等声称的被生物杀灭剂产品处理过的纺织品。
EU BPR的合规主要包括两个步骤,第一步是产品所用活性物质需要获得批准;第二步是产品要获得授权。针对活性物质批准,申请人需要提供充分的数据向主管当局证明物质的安全性和有效性。活性物质如果被归类为致癌、致畸、生殖毒性物质1类或2类的物质,被归类为持久性、生物累积性和毒性物质或为高持久性、高生物累积性物质,内分泌干扰物质,则不能通过评审。产品授权有很多不同的形式,比如一次授权就能获得整个欧盟市场准入的统一授权,使用BPR附件1所列的活性物质配置的产品可开展的简易授权等。企业可按照市场需求和产品特性,选择适合自己的授权形式。
2. EU BPR的目前进展
在活性物质批准层面,从2000年开始,主管当局制定了活性物质评估计划,对欧盟市场上存在的所有现有物质分阶段开展评估。活性物质评估计划将于2024年截止。但是截止到目前,进度凸显薄弱,仅完成了整个活性物质评估计划的35%。不过,从Klaus Berend先生提供的表格上看,活性物质批准的通过率是很高的。
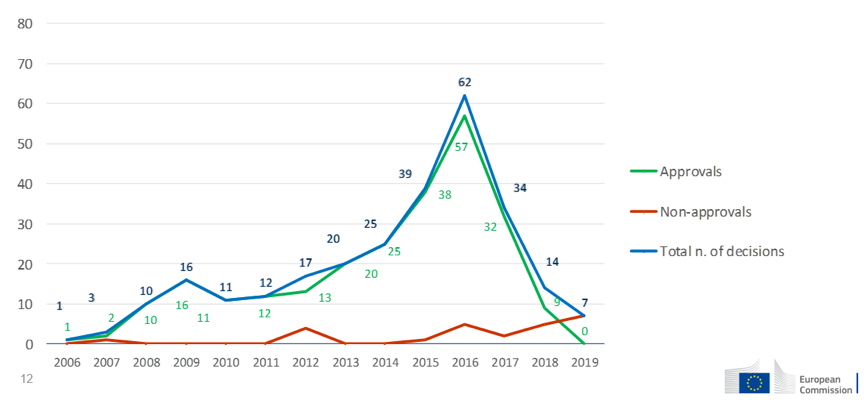
在产品授权层面,有11418个产品获得了授权,占比最高的国家是德国(767个),其次是西班牙(684个),法国(655个)和波兰(642个)。授权形式主要是成员国授权和互认,以及简易授权。但在2018年,欧盟授予了首个统一授权,后续陆续授予了21个产品统一授权,涵盖107个产品,目前在申请的统一授权的产品数量达到285个。
3. EU BPR的近期发展
首先,内分泌干扰评估于2017年发布。从2018年6月7日起,所有在评估进行中的活性物质都需要开展内分泌干扰评估。进一步规范内分泌干扰的指南文件,以及数据更新计划正在陆续制定和发布过程中。
其次,在新冠疫情下,欧盟委员会卫生和食品安全局在行动。比如与成员国讨论并研究BPR第55(1)条在特殊情况下的绿色通道,确保消毒剂稳步供应;开展迅速快捷的新供应商列入Art 95清单;向欧洲疾病预防和控制中心提供关于消毒剂使用指南的意见等。
上述解读均可通过点击下方链接观看直播回放






 化学品合规
化学品合规
 化妆品合规
化妆品合规
 检验检测
检验检测
 安全管理智能化
安全管理智能化
 绿色低碳可持续
绿色低碳可持续
 药品合规
药品合规
 食品合规
食品合规
 食品接触材料/再生塑料
食品接触材料/再生塑料
 中国农药登记
中国农药登记
 境外农药登记
境外农药登记