今年三月份疫情初期,美国环境环保署(EPA)针对能杀灭SARS-CoV-2(引起COVID-19的冠状病毒)的消毒剂产品注册申请开通了快速审查通道。

八月份,EPA批准了首个针对SARS-CoV-2的持久有效的消毒产品抗菌涂层,该产品只针对德克萨斯州的美国航空等公共场所消毒。

最近,为了确保美国人能够拥有尽可能多的消毒产品以用于对抗SARS-CoV-2,EPA发布了一项高效可残留消毒产品的快速通道指南。该指南为制造商和创新者提供了一条捷径,可使高效,持久及可残留的消毒产品尽快上市。

传统消毒剂和残留抗菌产品区别在哪?传统消毒剂只能杀死产品当下表面的病毒和细菌,而残留抗菌产品则能杀死在使用该产品数天、数周或数年后与表面接触的病原体。
符合本指南要求的具有残留功效声明的产品分为两大类:(1)除基本消毒外,还具有残留功效的消毒剂;(2)不符合EPA消毒剂标准但打算用作List N标准消毒剂的补充残留抗菌产品(例如,涂料,油漆,固体表面)。
I. 残留消毒剂要求
1. 合格产品必须满足标准消毒剂药效宣称的所有要求(非残留),才有资格获得残留消毒剂要求并经过测试以支持标准消毒剂药效宣称。
2. 为了能够支持声称为残留消毒剂的要求,需要遵循EPA的“残留消毒测试标准”开展测试。
II. 补充残留抗菌产品
3. 合格的抗菌表面涂层,薄膜,固定/固体和油漆产品应首先证明对植物性细菌具有功效,然后才能支持病毒声明。这些产品不需要达到消毒剂功效标准,只能被批准用作标准消毒剂的补充。
下表是这两类产品的功效要求对比总结:
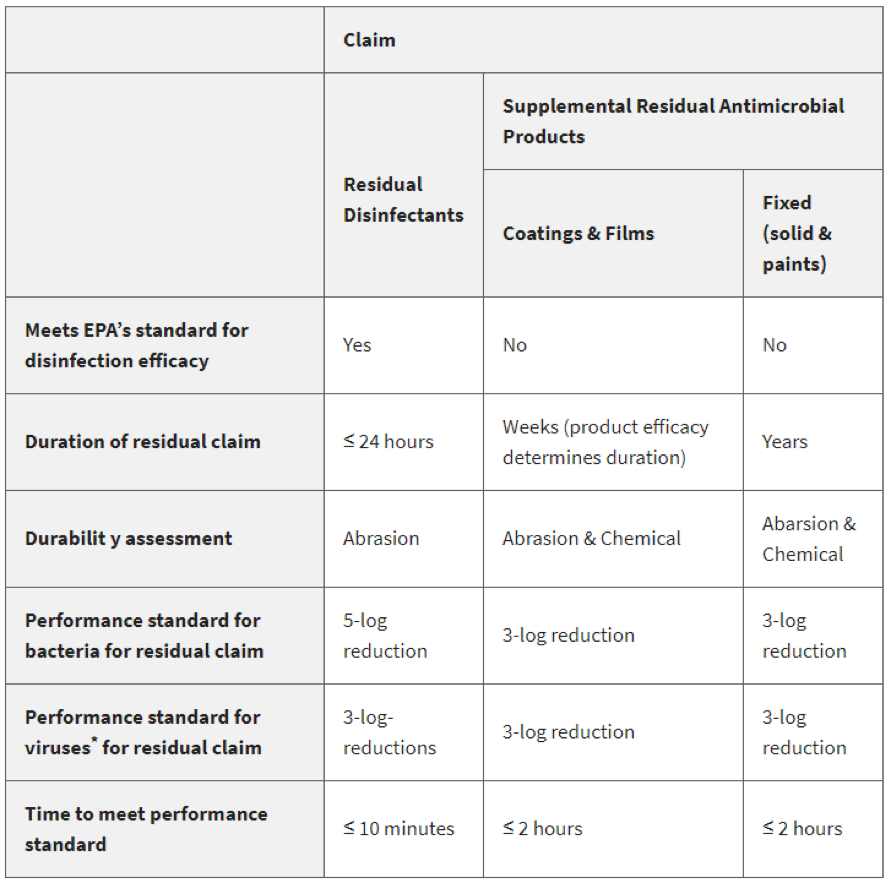
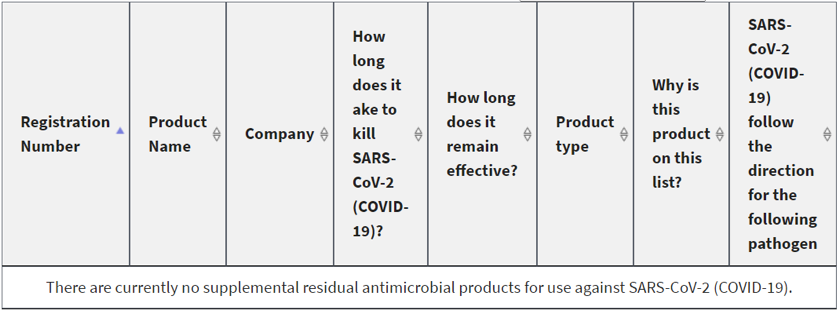
补充残留抗菌产品可以补充但不能替代EPA List N中针对SARS-CoV-2的消毒剂,批准的补充残留抗微生物产品不符合列入清单N的条件,但会添加到单独的 List N附录中。目前还没有补充的残留抗菌产品可用于对抗SARS-CoV-2。
与三月份针对杀灭SARS-CoV-2的消毒产品加快评审周期时间一致,按照本指南要求申请注册的残留消毒剂和补充残留抗菌产品,评审周期将比正常PRIA评审时间快1-2个月。
如需了解有关本指南的更多详情的企业,烦请联系:
电话:0571-87006630
邮箱:customer@reach24h.com





 化学品
化学品
 食品接触材料
食品接触材料
 化妆品
化妆品
 绿色双碳
绿色双碳
 境外农药登记
境外农药登记
 中国农药登记
中国农药登记