法规指南
2023年2月,国家药监局发布的《中药注册管理专门规定》(以下简称《专门规定》)第77条规定:中药说明书【禁忌】、【不良反应】、【注意事项】中任何一项在本规定施行之日起满3年后申请药品再注册时仍为“尚不明确”的,依法不予再注册。
2022年1月, 国家药监局发布《已上市中药说明书安全信息项内容修订技术指导原则(试行)》,提出了持有人应当加强对已上市中药的持续管理,主动开展药品上市后研究,对药品的非临床研究、临床试验、上市后研究、不良反应监测等信息综合研判,进行风险获益权衡,依据研究结果和不良反应监测数据等修订说明书安全信息项内容。
2021年1月,国家药监局关于发布《已上市中药变更事项及申报资料要求》的通告,提出了变更药品说明书中安全性等内容如修订警示语、【不良反应】、【禁忌】、【注意事项】、【药理毒理】以及特殊人群用药信息、【药物相互作用】等涉及安全性的项目,应提供申报资料4-10中与变更事项相关的资料。
适用范围
中药说明书的修订工作仅适用于境内生产的已上市中药,修订安全信息项主要包括警示语、不良反应、禁忌、注意事项和特殊人群用药等内容。
中药说明书修订情形
中药说明书的修订包括审批类变更和备案类变更。
审批类变更(主动型)
定义:药品上市许可持有人根据药品上市后收集到的产品安全性数据,主动开展的说明书安全性等内容的变更。
流程:审批类变更是持有人主动发起的,由国家药品监督管理部门审批的,主要是变更已上市中药药品说明书中安全性等内容。包括修订【警示语】、【不良反应】、【禁忌】、【注意事项】、【药理毒理】,及【特殊人群】、【药物相互作用】等项目。
备案类变更(被动型)
定义:药品上市许可持有人根据国家药品监督管理局发布的药品说明书修订公告补充完善说明书信息。
流程:备案类变更由药品上市许可持有人申报,在国家药品监督管理部门备案,是国家药品监督管理部门规定统一按要求补充完善说明书的变更和根据药品说明书内容变更标签相应内容等情况。
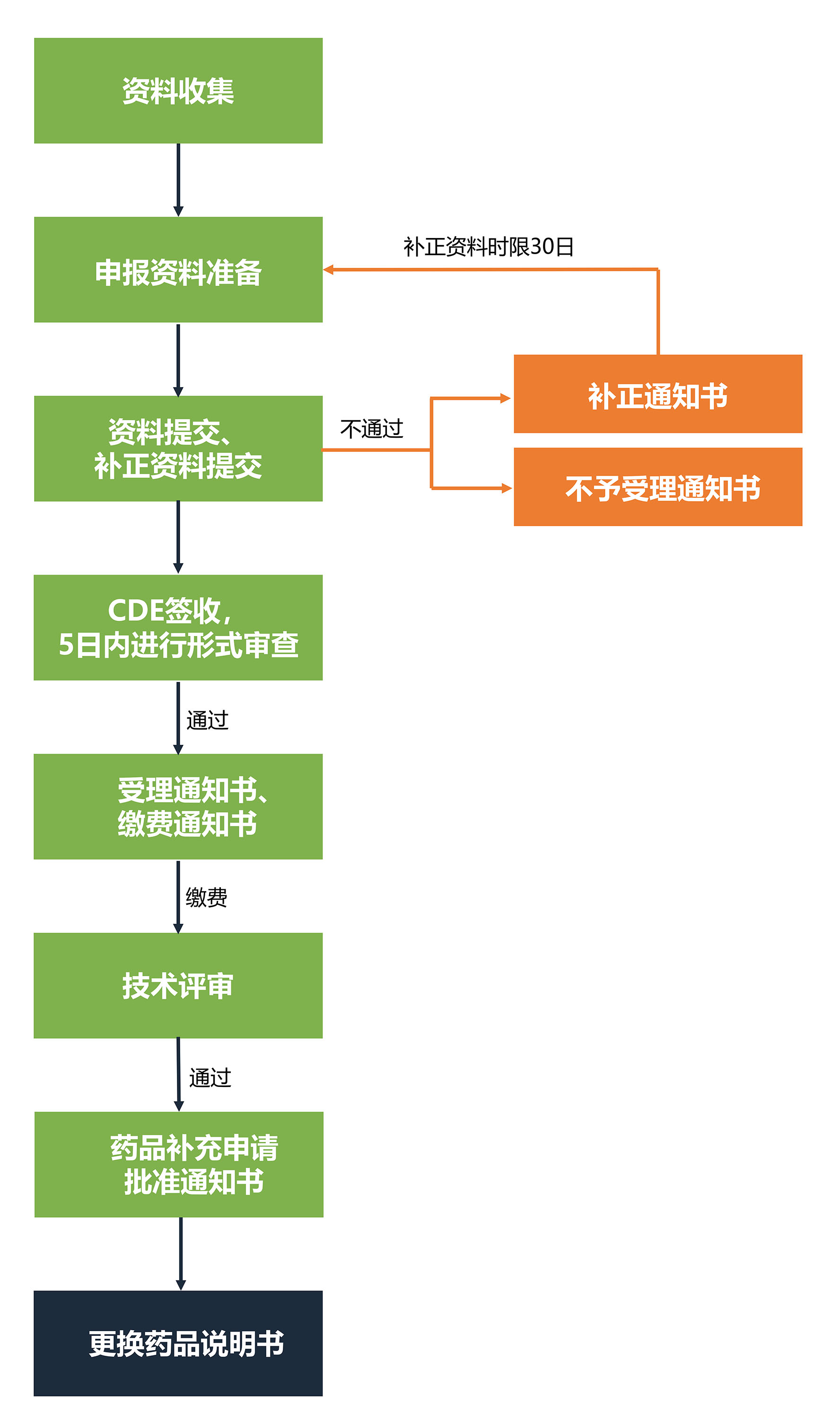
中药说明书修订流程
目前中药说明书修订主要集中于审批类变更,其流程如下图所示:
瑞欧佰药服务保障
瑞欧佰药作为一家专业医药咨询机构,可为中药说明书的安全性信息修订提供全方位的服务。
中药说明书准确性保障
我们致力于确保中药说明书的准确性和可靠性,以保障用户的安全和健康;
安全性信息完整性和清晰度
我们的专业团队将对中药产品的说明书进行详尽的审查和修订,确保其中所涉及的安全性信息完整、清晰,并符合相关法规和标准要求。
符合法规和标准要求
我们的服务旨在帮助中药企业提高产品的质量和安全性,为用户提供更可靠的使用指南,从而促进中药行业的可持续发展。
中药说明书修订服务流程
1. 说明书修订项目组组建
瑞欧佰药牵头组建说明书安全性信息修订项目组,成员由瑞欧佰药和申办方共同组成;
2. 产品安全性信息收集
由申办方提供产品相关安全性数据资料,瑞欧佰药负责产品说明书安全性信息收集工作,各种信息来源包含:上市后ADR、学术文献、监管部门公告、其他参考信息等。
3. 产品安全性信息分析
瑞欧佰药负责对收集完成的所有数据资料进行分析,确立药物相关信息,必要时会邀请相关专家对严重潜在风险进行讨论。
4. 安全性信息补充确认
根据产品安全性信息汇总分析结果,组织申办方共同确认说明书修改内容,修订完成最新版说明书样稿。
5. 说明书内容修订的交付
在时间范围内向申办方提供修订版中药说明书,并根据最新版说明书样稿编写完成申报材料。
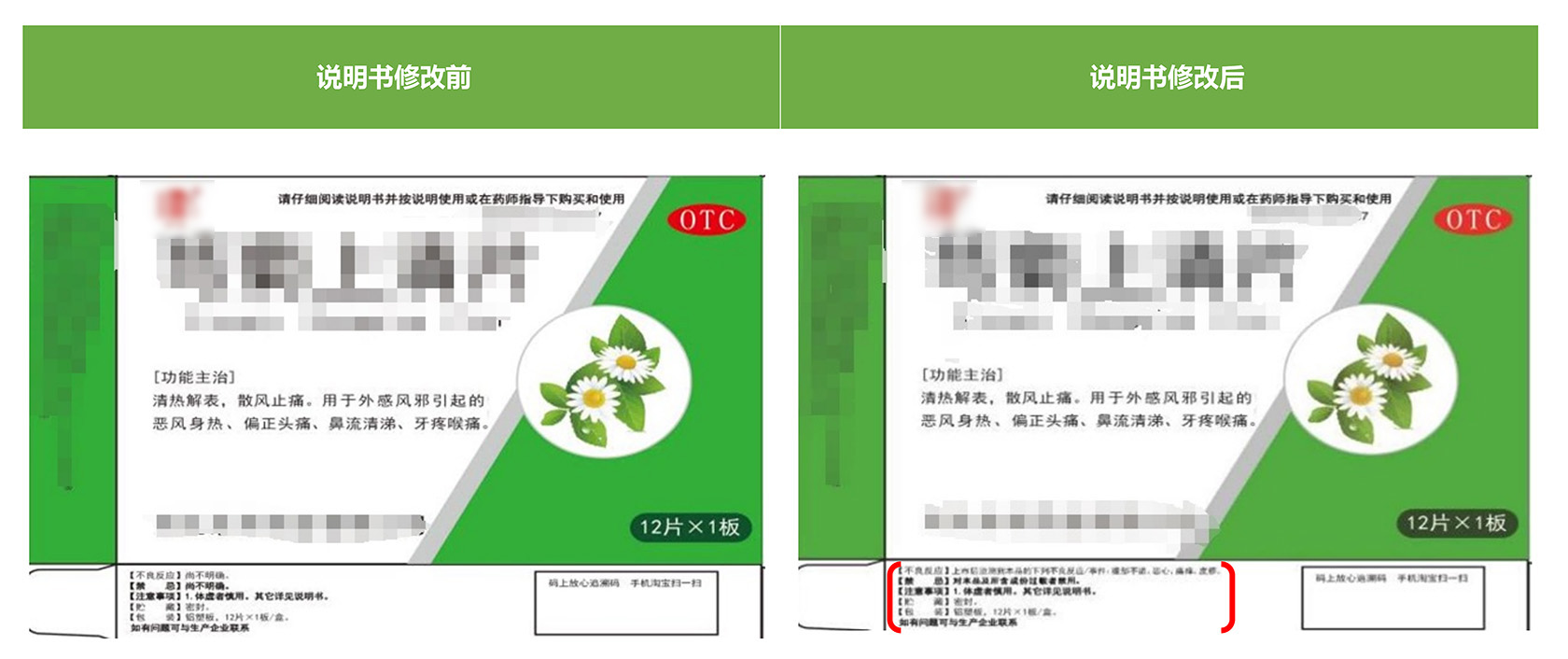
中药说明书修订案例
某国内上市药企委托本司进行某中药说明书修订,用时45天审批通过。其中,修改前后药品标签样稿如下图所示:
我们的优势
专业团队与多领域覆盖
瑞欧佰药拥有毒理学博士、中药学硕士、临床医学硕士以及数据统计分析等专业人员,团队资源涵盖中药药学、药理毒理、中医临床、药品警戒、法规等各环节。
丰富的项目实操经验
瑞欧佰药拥有丰富的项目实操经验,已完成多家企业中药说明书的安全性信息修订工作,熟悉各相关部门、单位的操作流程、模式,为项目开展保驾护航。
完备的项目管理与质保体系
瑞欧佰药具有完备的项目管理、质保体系,保证项目实施顺利进行。通过科学的项目管理和严格的质保措施,瑞欧佰药能够确保项目的质量、进度和成本都得到有效控制,从而为客户提供更优质的服务。






 化学品
化学品
 食品接触材料
食品接触材料
 化妆品
化妆品
 绿色双碳
绿色双碳
 境外农药登记
境外农药登记
 中国农药登记
中国农药登记